
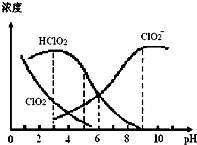
 亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 不同pH的NaClO2溶液中存在下列关系:c ( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) | |
| D. | 该温度下HClO2的电离平衡常数的数值:Ka≈1.0×10-6 |
分析 A.HClO2是漂白织物的有效成分,ClO2是有毒气体,应控制pH值范围使漂白剂的漂白性强,又要使ClO2浓度较小;
B.根据图知,该溶液呈碱性,则c(OH-)>c(H+),弱离子水解程度较小,结合电荷守恒判断;
C.溶液中可能还存在c(Cl-);
D.由HClO2的电离平衡常数K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$.
解答 解:A.HClO2是漂白织物的有效成分,ClO2是有毒气体,要使漂白剂的漂白性强,即HClO2的含量高,又要使ClO2浓度较小,根据图象知,pH过小,ClO2含量较大,pH过大,HClO2的含量较低,当溶液的pH为5.0左右,故A正确;
B.根据图知,该溶液呈碱性,则c(OH-)>c(H+),弱离子水解程度较小,结合电荷守恒得c( Na+)>c(ClO2-)>c(OH-)>c(H+),故B正确;
C.溶液中可能还存在c(Cl-),所以可能存在c( Na+)=c(ClO2-)+c(HClO2)+c(ClO2)+c(Cl-),故C错误;
D.由HClO2的电离平衡常数K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$,在pH=6时,c(HClO2)=c(ClO2-),则K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$=c(H+)=1.0×10-6,故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生图象分析及物质性质,明确物质性质及反应原理是解本题关键,注意溶液中存在微粒成分,易错选项是C,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 .
.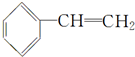 ,写出其发生加聚反应的化学方程式:
,写出其发生加聚反应的化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
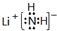 .
.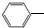 CH2CH3(g)?催化剂
CH2CH3(g)?催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| B. | 正戊烷的沸点高于丙烷 | |
| C. | 1 mol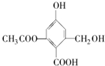 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、3mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、3mol、1 mol | |
| D. | 分子式为C4H8O2的有机物能与NaOH溶液反应的有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;三溴化磷
;三溴化磷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黏土 | B. | 纯碱、石灰石、石英砂 | ||
| C. | 黏土、石灰石 | D. | 二氧化硅、硅酸钙、硅酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl- | |
| B. | 0.1 mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO4 2-、Cl- | |
| C. | 0.1 mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| D. | c(H+):c(OH-)=1012mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com