
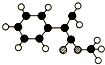
 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键). ,A中含有碳碳双键、苯环、酯基,所以应该具有烯烃、苯、和酯的性质;
,A中含有碳碳双键、苯环、酯基,所以应该具有烯烃、苯、和酯的性质; ,
, ;
; ,A中含有碳碳双键、苯环、酯基,所以应该具有烯烃、苯、和酯的性质;
,A中含有碳碳双键、苯环、酯基,所以应该具有烯烃、苯、和酯的性质;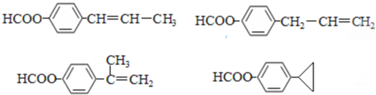 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已潮解 |
| B、向容量瓶加水时不慎超过了刻度线 |
| C、向容量瓶加水时眼睛一直俯视液面 |
| D、转移NaOH溶液后的烧杯没有洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
查看答案和解析>>
科目:高中化学 来源: 题型:
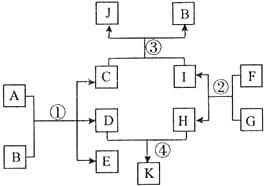 在如图所示的物质转化关系中(反应条件已略去).A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质.反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液.
在如图所示的物质转化关系中(反应条件已略去).A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质.反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比组分金属高 |
| B、合金中只含金属元素 |
| C、合金的机械性能一般比组分金属好 |
| D、合金不容易发生电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (O2)=0.01mol?(L?s) -1 |
| B、v (NO)=0.008mol?(L?s) -1 |
| C、v (H2O)=0.006mol?(L?s) -1 |
| D、v (NH3)=0.002mol?(L?s) -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com