
(14分)锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
将所得沉淀过滤、洗涤,
|
|
|
|
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是 
(1)将MnO2 还原成Mn2+ (2)Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O(3)既有MnCO3又有Mn(OH)2
①
实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
将沉淀充分暴露于空气中,观察颜色
| 颜色变成褐色,说明含有Mn(OH)2。 |
取少量沉淀于试管中,加入足量的盐酸,观察现象
| 没有气泡生成,说明不含MnCO3。 |
②300℃以后,质量增加量为MnO氧化为MnO2 ,计算可得MnCO3质量为11.5(或MnO(OH)2的质量为10.5g),所以既有MnCO3又有Mn(OH)2。
【解析】
试题分析:(l)在第②步中,将含有MnO2的固体与浓盐酸混合加热发生反应:MnO2+4H+ +2Cl-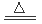 Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;(2)根据题意可知:在含有Mn2+离子的溶液中加入NH4HCO3溶液时发生的离子反应是Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O;(2)①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3。为此证明固体是Mn(OH)2。②固体质量最小值是15.8g是MnO的质量,在300℃以后,质量增加量为MnO氧化为MnO2。增加的质量是17.4-15.8=1.6g.所以n(MnO)=1.6g÷16g/mol=0.1mol。在15.8g固体中含有MnO质量为0.1mol× 71g/mol =7.1g.含有MnO215.8g-7.1g=8.7g.及含有MnO20.1mol。由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2。所以在原固体中含有Mn(OH)20.1mol,质量是0.1mol ×105g/mol =10.5g;则原固体中含有MnCO3质量为22.0g-10. 5g=11.5g。所以原固体中既有MnCO3又有Mn(OH)2。
Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;(2)根据题意可知:在含有Mn2+离子的溶液中加入NH4HCO3溶液时发生的离子反应是Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O;(2)①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3。为此证明固体是Mn(OH)2。②固体质量最小值是15.8g是MnO的质量,在300℃以后,质量增加量为MnO氧化为MnO2。增加的质量是17.4-15.8=1.6g.所以n(MnO)=1.6g÷16g/mol=0.1mol。在15.8g固体中含有MnO质量为0.1mol× 71g/mol =7.1g.含有MnO215.8g-7.1g=8.7g.及含有MnO20.1mol。由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2。所以在原固体中含有Mn(OH)20.1mol,质量是0.1mol ×105g/mol =10.5g;则原固体中含有MnCO3质量为22.0g-10. 5g=11.5g。所以原固体中既有MnCO3又有Mn(OH)2。
考点:考查物质的制取、成分的检验、离子方程式的书写的知识。


科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.FeCl3溶液中加入镁粉有气泡产生
B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性
C.铅蓄电池在放电过程中,负极质量减小,正极质量增加
D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:选择题
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
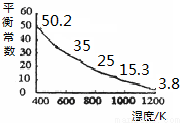
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第二次教学质量检测理科综合化学试卷(解析版) 题型:选择题
中科院合肥科学岛的专家建成“多功能铅铋堆技术综合实验回路KYLIN—Ⅱ”,该装置是世界最大的多功能液态铅铋综合实验平台,液态金属材料具有高效导热、高沸点、大容量储能的特点,具有广泛的应用前景。下列说法正确的是
A.液态金属铅中含有离子健 B.20.7g铅与足量稀盐酸反应生成2.24L氢气
C.可溶性铅盐会引起中毒 D.液态金属铅是由于其中的氢键作用而形成
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
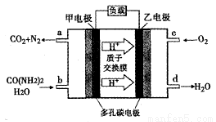
A、电池工作时H+ 移向负极
B、该电池用的电解质溶液是KOH溶液
C、甲电极反应式为:CO(NH2 )2 + H2O - 6e-= CO2 + N 2 + 6H+
D、电池工作时,理论每有净化1mol CO(NH2 )2 ,消耗 33.6 L O2
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:选择题
已知N2O4(g)?2NO2(g) △H>0且平衡体系的总质量(m总 )与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是( )

A.平衡常数K(a)=K(b)<K(c)
B.反应速率:va<vb ;
C.温度:T2>T1
D.当 =69g/mol时,若n(NO2):n(N2O4)=2:1,
=69g/mol时,若n(NO2):n(N2O4)=2:1,
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:填空题
下表列出了①~⑩十种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
| ① | ② |
|
|
|
3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑩ |
4 |
|
|
|
|
|
| ⑨ |
|
⑴上述①~⑩十种元素中(用元素符号填空):
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 。
⑵上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 。
⑶若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作______极(填“正”或“负”)
⑷元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体。若这两种气体混合,会生成一种淡黄色粉末。此反应化学方程式为 。若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值)。
⑸元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)
。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
下列变化中,不属于化学变化的是( )
A.SO2使品红溶液褪色 B.氯气使湿润的红色布条褪色
C.活性碳使红墨水褪色 D.“84”消毒液使某些染料褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
把含有FeBr2、FeI2各a mol的稀溶液两份,分别通入一定量的Cl2,第一份溶液中有一半的I― 被氧化成I2,第二份溶液中有一半的Br― 被氧化成Br2,两份通入Cl2的物质的量之比
A.1:1 B.1:2 C.1:3 D.1:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com