
| A. | 加入5 mL 盐酸时:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 加入10mL 盐酸时:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| C. | 在溶液pH=7 时:水的电离程度最大 | |
| D. | 加入20 mL 盐酸时:c(Cl-)=2c(NH4+) |
分析 A.加入5mL盐酸时,反应后溶质为等浓度的一水合氨和氯化铵,一水合氨的电离程度对应铵根离子的水解程度,则溶液呈碱性,c(NH4+)>c(Cl-);
B.根据溶液中的电荷守恒判断;
C.当二者恰好反应时,铵根离子发生水解,水的电离程度最大;
D.根据反应后溶液中的物料守恒判断.
解答 解:A.加入5mL 盐酸时,一水合氨过量,反应后溶质为等浓度的一水合氨和氯化铵,一水合氨的电离程度对应铵根离子的水解程度,溶液呈碱性,则c(OH-)>c(H+)、c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.加入10mL 盐酸时,根据电荷守恒可知:c(NH4+)+c(H+)=c(OH-)+c(Cl-),故B正确;
C.在溶液pH=7 时,溶液呈中性,基本不影响水的电离程度,当溶质为氯化铵时水的电离程度最大,故C错误;
D.加入20 mL 盐酸时,根据物料守恒可得:c(Cl-)=2c(NH4+)+2c(NH3•H2O),故D错误;
故选AB.
点评 本题考查了溶液酸碱性与溶液pH的计算、离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H4和C2H2 | B. | C2H4和C3H4 | C. | C3H6和C2H2 | D. | C3H6和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物碱性强弱:B>D | |
| B. | 微粒半径大小:B>A | |
| C. | C、E的最高价氧化物具有相似的物理性质和化学性质 | |
| D. | 由A、D两种元素的化合物中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
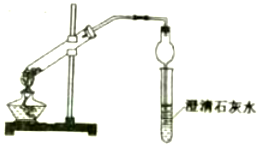 现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:
现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
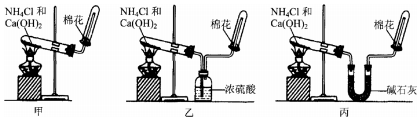
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Na+):n(Cl-) 可能为7:4 | |
| B. | 与NaOH反应的氯气一定为0.1mol | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40.75 | B. | 29.38 | C. | 14.69 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 湿润的淀粉碘化钾试纸遇氯气变蓝色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com