
五种短周期元素在周期表中的位置如图所示,其中Z元素原子的最外层电子数等于电子层数。下列判断正确的是
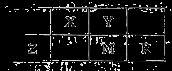
A.Z的氧化物可以做光导纤维
B.气态氢化物稳定性:M>R
C.最高价氧化物对应水化物的酸性:Y>X
D.Z、M、R的原子半径依次增大,最高化合价依次升高
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列关于有机物的叙述正确的是
A.甲烷、乙烯和苯都可通过石油分馏得到
B.乙烷和乙烯分别与Cl2反应均有二氯乙烷生成
C.甲醛、饱和(NH4)2SO4溶液都能使蛋白质发生变性
D.聚丙烯的结构简式为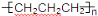
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:实验题
(12分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组拟制备NaNO2并测定产品纯度。
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO4-被还原为Mn2+。
Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。
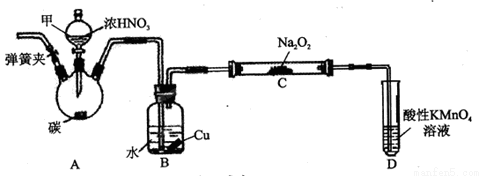
(1)装置A烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的作用是_________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是_________。(填字母编号)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.生石灰
Ⅲ【测定纯度】.
设计如下方案测定产品的纯度。

(4)溶液A到溶液B发生反应的离子方程式为____________________________。
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为__________。
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是________。(填字母编号)
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
下列过程没有发生化学反应的是
A.用氢氟酸来刻蚀玻璃器皿 B.用活性炭去除冰箱中的异味
C.用煤液化和气化得到清洁燃料 D.用热碱溶液清除炊具上残留的油污
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
纳米级Cu2O由于具有优良的催化性能而受到关注。采用离子交换膜控制电解液中OH一的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:2Cu+H2O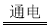 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
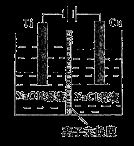
A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子离子交换膜
D.阳极反应式是:2Cu+2OH一一2e一== Cu2O+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列有关常见金属和非金属及其化合物的说法正确的是
A.Na、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应
B.CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物
C.铝热反应是指铝能将所有的金属从其氧化物中置换出来
D.CaCO3+SiO2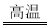 CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:填空题
(19分) (1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g)  H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
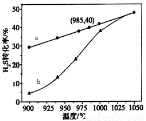
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。
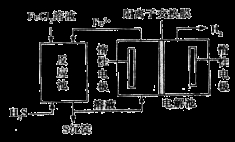
反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液的体积/ml | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a:b不可能为
A.3:2 B.4:5 C.2:3 D.3:4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体X仍无沉淀,则X可能是
A.CO2 B.NH3 C.NO2 D.H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com