
 ����·������ͼ��ʾ��
����·������ͼ��ʾ��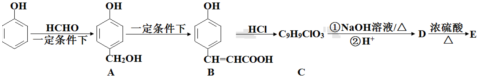
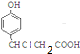 +3NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$
+3NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$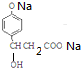 +NaCl+2H2O��
+NaCl+2H2O�� 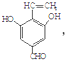 ��д�������ͬ���칹��Ľṹ��ʽ
��д�������ͬ���칹��Ľṹ��ʽ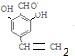 ��
��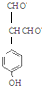 ��
�� ���� �Ա���Ϊԭ�Ϻϳ��л���E�� ����·�ߣ�
����·�ߣ�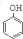 ��HCHO�����ӳɷ�Ӧ��
��HCHO�����ӳɷ�Ӧ�� +HCHO$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$
+HCHO$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$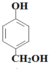 ��AΪ��
��A�� ��
��
A����HCHO�����ӳɷ�Ӧ������ȥ����B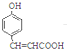 ��B�к���̼̼˫�������Ȼ��ⷢ���ӳɷ�Ӧ
��B�к���̼̼˫�������Ȼ��ⷢ���ӳɷ�Ӧ +HCl��
+HCl��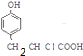 ��±�������������Ƶ�ˮ��Һ��ˮ��ɴ�
��±�������������Ƶ�ˮ��Һ��ˮ��ɴ�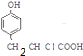 +NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$
+NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$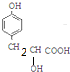 +NaCl��DΪ
+NaCl��DΪ ��D��Ũ����������·������Ӽ�������Ӧ��2
��D��Ũ����������·������Ӽ�������Ӧ��2
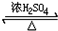
 +2H2O��E��
+2H2O��E�� ��
��
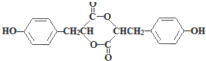
��1������E�Ľṹ��ʽ ��𣻱��Ӻ���HCHO�����ӳɷ�Ӧ����A��
��𣻱��Ӻ���HCHO�����ӳɷ�Ӧ����A��
��2��BΪ �����з��ǻ������ݷ��ǻ������ʷ�����̼̼˫��������ӳɣ�DΪ
�����з��ǻ������ݷ��ǻ������ʷ�����̼̼˫��������ӳɣ�DΪ �����ǻ����Ȼ������ǻ��������Na��Ӧ��
�����ǻ����Ȼ������ǻ��������Na��Ӧ��
��3��B��C��Ӧ�����п���±���ȼӳ����Ȼ�����̼�ϲ���һ�ָ�����C1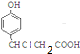 ������C1�ṹ������
������C1�ṹ������
��4������FeCl3����ɫ˵�����з��ǻ������ܷ���������Ӧ˵������ȩ�����ۺ˴Ź���������ʾ��������5�ֲ�ͬ��ѧ��������ԭ�ӣ������֮��Ϊ2��2��2��1��1��˵������������ԭ�Ӹ�����Ϊ2��2��2��1��1���ݴ˷������
��� �⣺�Ա���Ϊԭ�Ϻϳ��л���E�� ����·�ߣ�
����·�ߣ� ��HCHO�����ӳɷ�Ӧ��
��HCHO�����ӳɷ�Ӧ�� +HCHO$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$
+HCHO$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$ ��AΪ��
��A�� ��
��
A����HCHO�����ӳɷ�Ӧ������ȥ����B ��B�к���̼̼˫�������Ȼ��ⷢ���ӳɷ�Ӧ
��B�к���̼̼˫�������Ȼ��ⷢ���ӳɷ�Ӧ +HCl��
+HCl��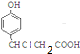 ��±�������������Ƶ�ˮ��Һ��ˮ��ɴ�
��±�������������Ƶ�ˮ��Һ��ˮ��ɴ�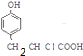 +NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$
+NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$ +NaCl��DΪ
+NaCl��DΪ ��D��Ũ����������·������Ӽ�������Ӧ��2
��D��Ũ����������·������Ӽ�������Ӧ��2
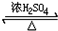
 +2H2O��
+2H2O��
��1��E�Ľṹ��ʽ ��E�к��еĹ�����Ϊ���ǻ���������
��E�к��еĹ�����Ϊ���ǻ��������� ��HCHO�����ӳɷ�Ӧ��
��HCHO�����ӳɷ�Ӧ�� +HCHO$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$
+HCHO$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$$\stackrel{һ������}{��}$ ��
��
�ʴ�Ϊ���ǻ����������ӳɷ�Ӧ��
��2�����ӷ������ǻ��Ա���Ӱ�죬�ڶ�λ��ԭ�ӻ��ã�����ȡ����Ӧ��BΪ ��1molB�������ǻ���λ��ԭ���ܷ���2molBr2ȡ����1molB����1mol̼̼˫�����ܺ�1mol�巢���ӳɣ�����1molB�����Ժ�3molBr2��Ӧ��DΪ
��1molB�������ǻ���λ��ԭ���ܷ���2molBr2ȡ����1molB����1mol̼̼˫�����ܺ�1mol�巢���ӳɣ�����1molB�����Ժ�3molBr2��Ӧ��DΪ �����ǻ����Ȼ������ǻ��������Na��Ӧ��1molD��3molNa��Ӧ������1.5mol���������ɱ�״���µ�v��H2 ��=n��vm=33.6L��
�����ǻ����Ȼ������ǻ��������Na��Ӧ��1molD��3molNa��Ӧ������1.5mol���������ɱ�״���µ�v��H2 ��=n��vm=33.6L��
�ʴ�Ϊ��3��33.6��
��3��B��C��Ӧ�����п���±���ȼӳ����Ȼ�����̼�ϣ�����C1Ϊ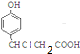 ��±�����ڼ���������ˮ��ɴ����������������Ʒ�Ӧ�����ǻ����������Ʒ�Ӧ������1mol��3mol�������Ʒ�Ӧ����ӦΪ��
��±�����ڼ���������ˮ��ɴ����������������Ʒ�Ӧ�����ǻ����������Ʒ�Ӧ������1mol��3mol�������Ʒ�Ӧ����ӦΪ��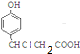 +3NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$
+3NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$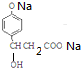 +NaCl+2H2O��
+NaCl+2H2O��
�ʴ�Ϊ��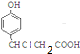 +3NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$
+3NaOH$\stackrel{��}{��}$$\stackrel{��}{��}$$\stackrel{��}{��}$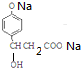 +NaCl+2H2O��
+NaCl+2H2O��
��4������FeCl3����ɫ��˵���з��ǻ������ܷ���������Ӧ��˵������ȩ�����ۺ˴Ź���������ʾ��������5�ֲ�ͬ��ѧ��������ԭ�ӣ������֮��Ϊ2��2��2��1��1��˵����ԭ�Ӹ�����Ϊ2��2��2��1��1�����ϵĽṹ��ʽ ��
��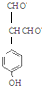 ��
��
�ʴ�Ϊ�� ��
��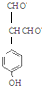 ��
��
���� ���⿼���л�����ƶϣ�Ϊ�߿��������ͣ�������ѧ���ķ����������ƶ��������ۺ����û�ѧ֪ʶ�������Ŀ��飬��Ŀ�Ѷ��еȣ�����������Ʒ��ƶϣ����ճ������л���Ӧ����Ϊ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
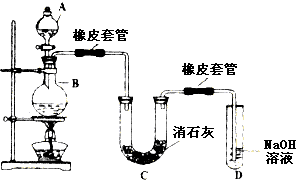
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
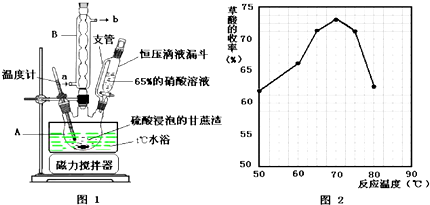
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2CO3���� | B�� | NaCl��Һ | C�� | ŨH2SO4 | D�� | KNO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ���ɱ����ۻ� | B�� | ʳ�κͱ������ۻ� | ||
| C�� | Һ���Һ�������� | D�� | ������ռ���ۻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
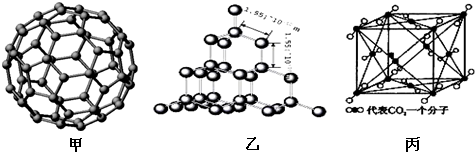
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 CH4 ��g��+4O2��g��=2CO2��g��+4H2O��l����H=+890kJ/mol | |
| B�� | CH4+2 O2=CO2+2H2O��H=-890kJ/mol | |
| C�� | CH4 ��g��+2O2��g��=CO2��g��+2H2O��l����H=-890kJ/mol | |
| D�� | $\frac{1}{2}$CH4 ��g��+O2��g��=$\frac{1}{2}$CO2��g��+H2O��g����H=-445kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư�۾� | B�� | ������ | C�� | ���� | D�� | ���ȼ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com