
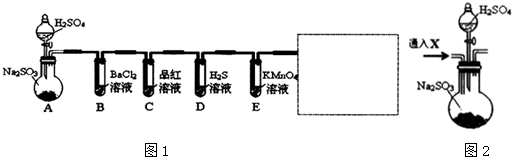
分析 (1)装置A中生成的二氧化硫气体具有漂白性、还原性等,通过装置C中的品红溶液会褪色表现了二氧化硫的漂白性,二氧化硫通过装置E中的高锰酸钾溶液,还原高锰酸钾溶液褪色;
(2)二氧化硫酸性气体尾气用浓的氢氧化钠吸收;
(3)白色沉淀不溶于稀盐酸,该沉淀只能为硫酸钡;可能原因为亚硫酸被氧化成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀;连接后往装置F中通入气体X一段时间,排除装置中的氧气,通入的气体不能氧化二氧化硫,干扰验证实验;
(4)①用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,说明滤液中不含有Cl-;
②利用关系式:SO2~SO42-~BaSO4,根据BaSO4沉淀的质量求出SO2的体积,最后求出体积分数;
解答 解:(1)装置A中生成的二氧化硫气体具有漂白性、还原性等,通过装置C中的品红溶液会褪色表现了二氧化硫的漂白性,二氧化硫通过装置E中的高锰酸钾溶液,还原高锰酸钾溶液褪色,表现了二氧化硫的还原性,
故答案为:漂白性,还原性;
(2)二氧化硫酸性气体尾气用浓的氢氧化钠吸收,装置为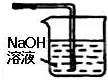 ,故答案为:
,故答案为: ;
;
(3)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,向试管中加入过量稀盐酸,沉淀不溶解,该白色沉淀为BaSO4,产生沉淀的原因可能为,
B中形成沉淀是二氧化硫被氧气氧化,可能发生的反应为:2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl或2SO2+2H2O+O2=2H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl,
O3和NO2,具有氧化性,能氧化二氧化硫,所以不可以通入气体这两种气体驱赶装置中的氧气,NH3是碱性气体和二氧化硫发生反应生成亚硫酸铵,不能达到大量二氧化硫气体,所以选择二氧化碳或氮气排除装置中的空气,选AD,
故答案为:2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl或2SO2+2H2O+O2=2H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl,AD;
(4)①沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次.检验洗涤沉淀已经干净的实验操作:取最后一次洗涤液,溶液中加入AgNO3溶液,无沉淀出现,说明滤液中不含有Cl-,即沉淀已洗涤干净,
故答案为:取最后一次洗涤液,溶液中加入AgNO3溶液,无沉淀出现,说明滤液中不含有Cl-,即沉淀已洗涤干净;
②SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况),缓慢通过足量溴水中,在所得溶液中加入过量BaCl2溶液,将产生的白色沉淀洗涤,干燥,用电子称称其质量为0.233g,
利用关系式:SO2 ~SO42-~BaSO4,
0.001mol $\frac{0.233g}{233g/mol}$=1×10-3mol
n(SO2)=n(BaSO4)=1×10-3mol
10m3空气中SO2的体积分数为$\frac{1×1{0}^{-3}mol×64×1000mg/mol}{10{m}^{3}}$×100%=6.4mg/m3,
故答案为:6.4mg/m3;
点评 本题属于实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用氨水将SO2转化为(NH4)2SO3、(NH4)2SO4 |
| 方法Ⅱ | 用生石灰吸收SO2,再转化为CaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由石油可以制得汽油 | |
| B. | 乙醇汽油是一种新型的化合物 | |
| C. | 汽车使用乙醇汽油可以减少有害气体的排放 | |
| D. | 由玉米、高梁发酵可以制得乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com