
【题目】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__。
(2)用盐酸酸浸时发生反应的离子方程式为:__,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__mol/L。
【答案】+4 BaCO3+2H+=Ba2++CO2↑+H2O 适当加热可提高反应速率,但温度过高会加快盐酸挥发,反应物浓度降低又会使酸浸速率降低 漏斗、烧杯、玻璃棒 取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若无白色沉淀产生,说明已洗净 促进TiCl4水解 60% 5.16×10-8
【解析】
由制备实验流程可知,BaCO3用盐酸酸浸得到氯化钡溶液,再向氯化钡混合液中加入TiCl4溶液和草酸溶液得到草酸氧钛钡晶体和HCl,生成的HCl可循环利用,最后通过洗涤、干燥煅烧草酸氧钛钡晶体得到BaTiO3;
(1)化合物中正负化合价的代数和为0;
(2)BaCO3与盐酸反应生成氯化钡、水、二氧化碳;盐酸具有挥发性,温度过高加快挥发;
(3)过滤需要烧杯、漏斗、玻璃棒,取最后一次的洗涤液检验是否含氯离子,确定是否洗涤干净;
(4)用TiCl4水解来制备,制备时需加入大量的水,同时加热,可促进水解;
(5)结合BaCO3~BaTiO3计算;
(6)出液中c([Ba2+)=0.05mol/L,结合25℃时BaCO3的溶度积Ksp=2.58×10-9计算。
(1)BaTiO3中Ba的化合价为+2价,O的化合价为-2价,根据化合物中元素的正负化合价代数和为0,Ti的化合价为+4价;
(2)盐酸酸浸时反应的化学方程式BaCO3+2HCl=BaCl2+H2O+CO2↑,离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑;适当加热可提高反应速率,但温度过高会加快盐酸挥发,反应物浓度降低又会使酸浸速率降低;
(3)①过滤操作中使用的玻璃仪器有烧杯、漏斗、玻璃棒;
②根据流程草酸氧化钛钡晶体吸附可溶性的Cl-等,要证明晶体已经洗净即证明洗涤液中不含Cl-。方法是:取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若无白色沉淀产生,说明已洗净;
(4)TiCl4水解的离子方程式为TiCl4+2H2OTiO2+4HCl,加入大量水促进TiCl4水解,盐的水解是吸热过程,加热促进TiCl4水解,制备时加入大量的水同时加热,目的是促进TiCl4的水解;
(5)根据Ba守恒,理论上得到BaTiO3的质量为![]() ×233g/mol=23.3g,BaTiO3的产率为
×233g/mol=23.3g,BaTiO3的产率为![]() ×100%=60%;
×100%=60%;
(6)BaCO3的溶解平衡表达式为BaCO3(s)Ba2+(aq)+CO32-(aq),Ksp(BaCO3)=c(Ba2+)·c(CO32-)=2.58×10-9,若浸出液中c(Ba2+)=0.05mol/L,则CO32-在浸出液中最大浓度c(CO32-)=2.58×10-9÷0.05mol/L=5.16×10-8mol/L。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1molL-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1molL-1
D.常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.常温下,![]() 的
的![]() 与
与![]() 混合溶液中:
混合溶液中:![]()
B.NaCl溶液和![]() 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C.相同温度下,若![]() ,则AgCl的溶解度大于
,则AgCl的溶解度大于![]()
D.醋酸溶液加少量水稀释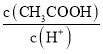 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积约为1×10-12,将VaL pH=2的硫酸溶液与VbL pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为 ( )
A. 2∶11B. 2∶9C. 11∶2D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)_________________________。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的__________中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为________(填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
化学式 | HCN | CH3COOH | H2CO3 |
电离平衡常数 | K=4.9×1010 | K=1.8×105 | K1=4.4×107 K2=4.7×1011 |
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为________________(填序号)。
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为__________mol·L1,此时溶液中c(CrO42)为_________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为___。
(2)“碱浸”过程中发生的离子方程式是___。
(3)“酸浸”时所加入的酸是___(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是___。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是___。
(5)“调pH为2~3”的目的是___。
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),其原因可能是__ 、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)![]() 2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
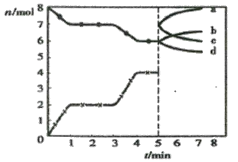
A.0~1min,v(CO)=1 mol/(L·min);1~3min时,v(CO)=v(CO2)
B.当容器内的压强不变时,反应一定达到平衡状态,且![]()
C.3min时温度由T1升高到T2,则Q>0,再达平衡时![]()
D.5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com