
| A. | 硫酸与氢氧化钡在溶液中反应:Ba2++SO42-═BaSO4↓ | |
| B. | 在NaOH溶液中加入醋酸溶液:H++OH-═H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 向FeI2溶液中通入过量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.漏写生成水的离子反应;
B.醋酸在离子反应中保留化学式;
C.反应生成氯化钠、水、二氧化碳;
D.过量氯气,亚铁离子、碘离子均被氧化.
解答 解:A.硫酸与氢氧化钡在溶液中反应的离子反应为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故A错误;
B.在NaOH溶液中加入醋酸溶液的离子反应为CH3COOH+OH-═H2O+CH3COO-,故B错误;
C.用小苏打治疗胃酸过多的离子反应为HCO3-+H+═CO2↑+H2O,故C正确;
D.向FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
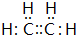 ;
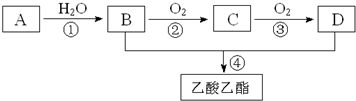
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
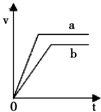 取两份10mL 1mol•L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,得到气体的体积如a所示,则另一种物质是( )
取两份10mL 1mol•L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,得到气体的体积如a所示,则另一种物质是( )| A. | 铝粉 | B. | 3 mol•L-1稀硫酸 | C. | 铁粉 | D. | 氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
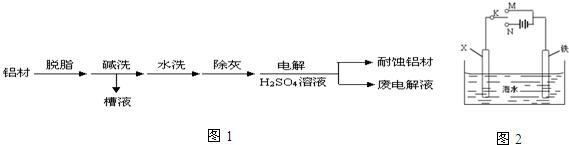
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润 | |
| B. | 容量瓶用蒸馏水洗净、必须烘干后才能用于溶液的配制 | |
| C. | 用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 | |
| D. | 中和滴定时,锥形瓶不需要用待测液润洗后就能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Fe2+将饮用水中少量ClO2-氧化成为Cl-:4Fe2++ClO2-+4H+═4Fe3++Cl-+2H2O | |
| B. | 向烧碱溶液中加入铝:Al+2OH-═AlO2-+H2↑ | |
| C. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O═SO32-+2NH4++H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:
BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:| 时间/min | 0 | t | 2t | 3t | 4t |
| n(H2)/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
| 试验编号 | T/℃ | c起始(H2)/mol•L-1 | 重晶石的比表面积/m2•g-1 |
| Ⅰ | 850 | c1 | 3.4 |
| Ⅱ | T1 | 0.80 | 7.6 |
| Ⅲ | 900 | 0.80 | 7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑧ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
| 4 | ② | ④ |
 ;元素⑥的气态氢化物分子式SiH4.
;元素⑥的气态氢化物分子式SiH4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com