
| A. | ①③④ | B. | ②③⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
分析 CH3COONa稀溶液中醋酸根离子水解生成CH3COOH、NaOH,使$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小,可使水解平衡正向移动,以此来解答.
解答 解:①NaOH固体,水解平衡逆向移动,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故不选;
②NaHSO4固体,与NaOH反应,水解平衡正向移动,使$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小,故选;
③氯化钠水溶液,水解平衡正向移动,使$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小,故选;
④CH3COONa固体,水解平衡虽正向移动,但醋酸根离子浓度增大的多,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故不选;
⑤冰醋酸,醋酸分子浓度增大的多,使$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小,故选;
⑥降低温度,水解平衡逆向移动,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故不选;
故选B.
点评 本题考查水解平衡移动,为高频考点,把握水解平衡移动的影响因素为解答的关键,侧重分析与应用能力的考查,注意温度、浓度对水解的影响,题目难度不大.


科目:高中化学 来源: 题型:实验题
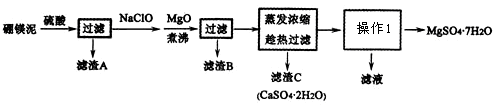
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
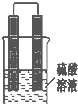 甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•
甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•查看答案和解析>>
科目:高中化学 来源: 题型:解答题
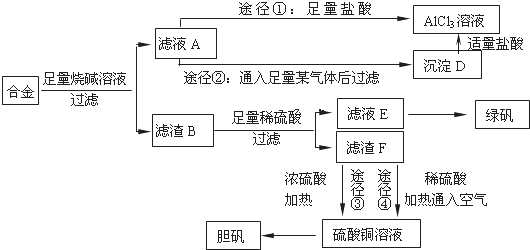
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
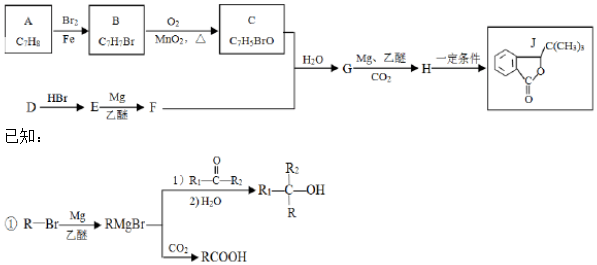
 .
. (写结构简式).
(写结构简式).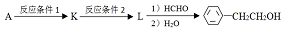
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒 | B. | HF可用于雕刻玻璃 | ||
| C. | NH3可用于制硝酸 | D. | SiO2可用于制太阳能电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com