
【题目】下列关于原电池的说法中,错误的是( )
A. 原电池是一种将化学能直接转化为电能的装置B. 原电池中,正极发生氧化反应
C. 原电池的电子从负极经导线流向正极D. 原电池的负极材料一般比正极活泼
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) ![]() CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) ![]() CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。
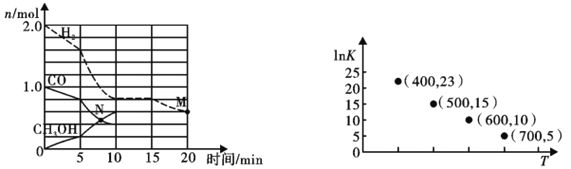
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二水合草酸镓的结构如图所示,其中镓原子在周期表中的位置为__________,草酸根中碳原子的杂化方式为__________。

(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验 Fe2+的试剂,1mol CN-中含 π 键的数目为______ ,临床建议服用维生素 C 促进“亚铁”的吸收,避免生成 Fe3+,从原子结构角度来看,Fe2+易被氧化成 Fe3+的原因是___________。
(3)化合物(CH3)3N 与盐酸反应生成[(CH3) 3NH]+,该过程新生成的化学键为______(填序号)
a. 离子键 b. 配位键 c. 氢键 d. 非极性共价键
若化合物(CH3)3N 能溶于水,试解析其原因____________________。
(4)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断 Ni2+的水合离子为 __________(填“有”或“无”)色离子,依据是_____________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.

请根据混合物分离或提纯的原理,将A、B、C、D 填入适当的空格中.
(1)用四氯化碳碘水中提取碘_____;
(2)除去粗盐中的泥沙_____;
(3)与海水晒盐原理相似的是_____;
(4)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在南朝刘宋雷敩所著的《雷公炮炙论》中收录了一种矿物类药材石髓铅,又称自然铜,具有活血化瘀止痛的效果。今用现代分析技术检测一份石髓铅样品,发现其含铜极少,含有铁元素的质量分数为44.8%,硫元素的质量分数为51.2%。回答下列问题:
(1)石髓铅的主要成分是一种化合物(质量分数为96%),化学式为_________;石髓铅粉末几乎能完全溶于硫酸酸化的高锰酸钾溶液中,形成多种硫酸盐的混合液,写出主要反应的离子方程式:______________________。
(2)利用石髓铅、焦炭和氧气在高温下反应可制造硫磺,副产品为Fe3O4和CO。Fe3O4是_____色晶体,可用于制作复印机的墨粉,CO可用于合成在纺织工业中广泛使用的保险粉(Na2S2O4),其流程如下:

合成塔I中得到的HCOONa溶液溶质质量分数约为5%,从中分离出HCOONa·2H2O的主要步骤是、______、过滤、洗涤、干燥;合成塔II中发生主要反应的化学方程式为____________。保险粉暴露在空气中易吸收氧气和水蒸气而变质,当吸收自身物质的量一半的氧气和一定量水蒸汽时,变质形成____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H= +216.4 kJ /mol
CO(g)+3H2(g) △H= +216.4 kJ /mol
b.CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H =-41.2 kJ/mol
CO2(g)+H2(g) △H =-41.2 kJ/mol
则反应CH4(g) +2H2O(g)![]() CO2(g)+4H2(g) △H=_________。
CO2(g)+4H2(g) △H=_________。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

①恒压时,反应一定达到平衡状态的标志是______(填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.c(H2)/c(NH3) 比值保持不变 D.c(NH3)/c(N2) 等于2
②P1_____P2 (填“ > ”、“< ”、“=”,下同);反应平衡常数:B点____D点;
③在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:υ(A)______ υ(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式__________;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O![]() N2H5++OH- K1= 1×10-a;
N2H5++OH- K1= 1×10-a;
N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________(用含a、b式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com