
A是某天然蛋白质一定条件下发生水解得到的产物之一。经测定:A的相对分子质量不超过200,其中氧元素所占质量分数约为26.5%;等物质的量的A分别与NaOH、Na充分反应,消耗两者的物质的量之比为1:2;经仪器分析A分子中含有苯环,不含“—CH2—”和“—CH3”基团。
(1)测定A的相对分子质量的仪器是________,A的摩尔质量为________。
(2)一定条件下A分子间发生反应生成聚酯的化学方程式为:____________。
(3)A的同分异构体有多种,写出符合下列条件的所有同分异构体的结构简式:________________________
①与A具有相同的官能团,是二取代苯,且苯环上的一溴代物有两种;
②催化氧化产物能发生银镜反应;
③分子中氨基与羧基的位置关系,与A分子氨基与羧基的位置关系不同。
科目:高中化学 来源: 题型:
有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3
下列各项排序正确的是( )
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④
D.c(CH3COOH):①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如平面图所示),经过一段时间后,首先观察到溶液变红的区域是( )
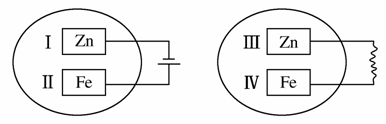
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近
C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为相互串联的①、②两电解池。试回答:
(1)若①池利用电解原理在铁上镀银,则A是________、________(填电极材料和电极名称),电极反应式是__________________;B(要求同A)是________、________,电极反应式是___________________,选用的电解质溶液是________溶液。
(2)②池中若滴入少量酚酞试液,电解一段时间后,铁极附近呈______色,C极附近呈______色。
(3)若①池阴极增重43.2 g,则②池中阳极上放出的气体在标准状况下的体积是________mL。若②池中剩余溶液仍为400 mL,则电解后所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
工程塑料PBT的结构简式为
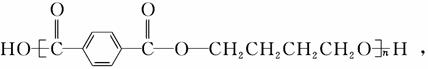 下列有关PBT的说法正确的是 ( )。
下列有关PBT的说法正确的是 ( )。
A.PBT是加聚反应得到的高分子化合物
B.PBT分子中含有羧基、羟基和酯基
C.PBT的单体中有芳香烃
D.PBT的单体均能与Na、NaOH、Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件略去):
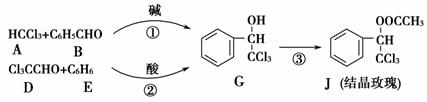
(1)A的类别是________,能与Cl2反应生成A的烷烃是________。B中的官能团是________。
(2)反应③的化学方程式为______________________。
(3)已知:B 苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液, 能除去的副产物是________。
苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液, 能除去的副产物是________。
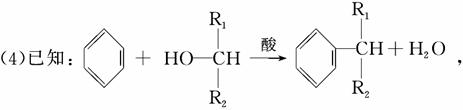
则经反应路线②得到的一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为________。
(5)G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生, 则L与NaOH的乙醇溶液共热,所得有机物的结构简式为__________________________________________________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平):
 ……
……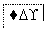
图1
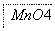
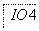

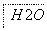
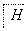
图2
对于该离子方程式的说法不正确的是 ( )。
A.IO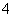 作氧化剂
作氧化剂
B.氧化性:Mn2+>IO
C.氧化剂与还原剂的物质的量之比为5∶2
D.若有2 mol Mn2+参加反应时,则转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
回答下列问题:
(1)Mn元素价电子层的电子排布式为____________,比较两元素的I2、I3可
知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的
解释是___________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成
配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是
__________________________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。
易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
____________晶体。
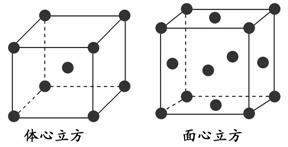
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心
立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com