
分析 反应3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2中,Fe元素化合价升高,被氧化,Fe为还原剂,H元素化合价降低,被还原,H2O为氧化剂,结合方程式进行计算.
解答 解:由方程式可知,Fe元素化合价升高,被氧化,Fe为还原剂,H元素化合价降低,H2O为氧化剂,被还原,由方程式,若反应中生成了1mol Fe3O4,则消耗3mol Fe;因为Fe3O4中,Fe元素化合价分别为+2价、+3价,所以Fe3O4与稀盐酸反应生成的盐为FeCl2和 FeCl3,故答案为:Fe;H2O;3;FeCl2和 FeCl3.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识相关概念以及物质的性质,难度不大.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
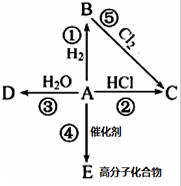 烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用玻璃棒搅拌漏斗中的液体可以加快过滤的速度 | |
| B. | 用澄清的石灰水可鉴别CO2和SO2 | |
| C. | 某元素从化合态变为游离态时,该元素可能被氧化也可能被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和稀硫酸 | B. | Fe和FeCl3溶液 | C. | FeO和稀硫酸 | D. | Fe2O3和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2 | B. | BaCl2 | C. | HNO3 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Na+、OH-、K+ | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
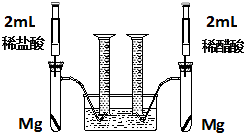 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com