
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l)=3N2(g)+4H2O(g)△H= —103 8.7kJ.mol—1
若该反应中有4mol N—H键断裂,则形成的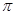 键有
mol。
键有
mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___ 。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
(1)2s22p3 (2分)
(2)N>O>C(2分)
(3)①sp3 (2分) ②3(2分) ③d(2分)
(4)共价键(1分)
(5)4(1分) 4(1分)  (2分)
(2分)
【解析】
试题分析:(1)根据构造原理可写出基态氮原子的价电子排布式是2s22p3。
(2)非金属性越强,第一电离能越大。但由于N中的2p是半充满,稳定性强,所以第一电离能大于O的,顺序为N>O>C。
(3)①NH3分子中中心原子含有1对孤对电子,所以是三角锥形结构。NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。
②根据反应式可知,当反应中有4mol N-H键断裂时,必然会生成1.5mol氮气。由于三键中含有2个π键,所以形成的π键有3mol。
③硫酸铵是离子化合物,含有离子键、极性键、配位键。但没有范德华力。所以答案选d。
(4)B与N为非金属元素,层内B原子与N原子之间的化学键为共价键。
(5)金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×1/8 + 6×1/2 + 4 = 8,因此立方氮化硼晶胞中应该含有4个N和4个B原子。立方氮化硼的一个晶胞中含有4个N和4个B原子,故“每个BN分子”所占的体积为(361.5×10-10cm)3/4
,每mol的体积为(361.5×10-10cm)3×NA/4,每mol的质量为(361.5×10-10cm)3×NA×ρ/4=25,故立方氮化硼的密度是 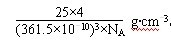 。
。
考点:本题考查电子排布式的书写、电离能比较、微粒间相互作用、晶胞的分析与计算。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I:氮元素可以形成多种化合物.回答以下问题:
I:氮元素可以形成多种化合物.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com