
分析 HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{2}{3}$就停止了,则氯化氢体积=$\frac{2}{3}$VL,溶液体积为$\frac{2}{3}$VL,n(HCl)=$\frac{\frac{2}{3}VL}{22.4L/mol}$=$\frac{2}{3×22.4}$mol,根据c=$\frac{n}{V}$计算盐酸浓度.
解答 解:HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{2}{3}$就停止了,则氯化氢体积=$\frac{2}{3}$VL,溶液体积为$\frac{2}{3}$VL,n(HCl)=$\frac{\frac{2}{3}VL}{22.4L/mol}$=$\frac{2}{3×22.4}$mol,盐酸浓度c=$\frac{n}{V}$=$\frac{\frac{2}{3×22.4}mol}{\frac{2}{3}L}$=$\frac{1}{22.4}$mol/L=0.045mol/L,故答案为:0.045.
点评 本题考查物质的量的有关计算,侧重考查学生分析判断及计算能力,明确水上升体积与HCl气体体积关系是解本题关键,熟悉物质的量公式中各个物理量的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构的相关叙述 |
| T | 失去一个电子后,形成与Ne相同的核外电子排布 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
| Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
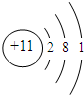 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com