
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH=__kJ·mol-1
CH3OH(g) ΔH=__kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是__(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1__p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=__(mol·L-1)-2;
③在其它条件不变的情况下,再增加amolCO和2amolH2,达到新平衡时,CO的转化率__(填“增大”、“减小”或“不变”)。
【答案】-90.1 ac 小于 ![]() 增大
增大
【解析】
(1)用CO可以合成甲醇。由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)CH3OH(g);
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,通过反应方程式和公式K=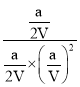 可以求得;
可以求得;
③在其它条件不变的情况下,再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大;
(1)(1)用CO可以合成甲醇。已知:①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;②CO(g)+
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;②CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0kJmol-1;③H2(g)+
O2(g)=CO2(g)△H=-283.0kJmol-1;③H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8kJmol-1;由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)CH3OH(g)△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为:-90.1;
O2(g)=H2O(l)△H=-285.8kJmol-1;由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)CH3OH(g)△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为:-90.1;
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢,故答案为:ac;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2,故答案为:小于;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L)![]()
![]() 0
0
转化浓度(mol/L)![]()
![]()
![]()
平衡浓度(mol/L)![]()
![]()
![]()
所以平衡常数K=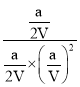 =
=![]() ,
,
故答案为: ![]() ;
;
③在其它条件不变的情况下,再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大,故答案为:增大;


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在曲线的A、B间,溶液中可能有![]()
B.在B点,![]() ,且有
,且有![]()
C.在C点,![]()
D.在D点,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )

A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为0.1molL-1的①NH4Cl溶液,②NaCl溶液,③HCl溶液各20mL,下列说法错误的是( )
A.三种溶液中c(Cl-)的关系是①=②=③
B.若将三种溶液稀释相同的倍数,pH变化最小的是②
C.三种溶液中由水电离出的c(H+)的关系是①<②<③
D.若向三种溶液中分别加入20mL0.1molL-1的NaOH溶液后,pH最小的是③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应mA(g)+n(B)![]() cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,
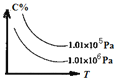
下列该反应的![]() 、
、![]() 判断正确的是
判断正确的是
A.![]() >0,
>0,![]() <0B.
<0B.![]() <0,
<0,![]() >0
>0
C.![]() >0,
>0,![]() >0D.
>0D.![]() <0,
<0,![]() <0
<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,R-和Y+的简单离子相差8个电子。甲、乙化合物均含上述四种元素;常温下,0.01molL-1甲溶液的pH=2,0.01molL-1乙溶液的pH=a(2<a<7)。向乙溶液中滴加甲溶液,产生气体的物质的量与甲的物质的量关系如图所示(假设气体全部排出)。下列说法不正确的是( )
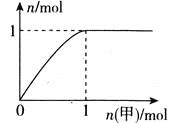
A.简单的离子半径:Z>X>Y
B.简单气态氢化物的热稳定性:X>Z
C.甲、乙中均含有离子键和共价键
D.常温下,甲、乙溶液中由水电离出的H+和OH-之间存在:c(H+)水c(OH-)水=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内只有一个质子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。回答下列问题:
(1)C在元素周期表中的位置为______,G的原子结构示意图为______。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为______,所含化学键类型为______,向甲中滴加足量水时发生反应的化学方程式为______。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序为______(用离子符号表示)。
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极,在a极通入BA4气体,b极通入D2气体,则a极是该电池的______极,正极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com