
【题目】工业上以乙苯催化脱氢制取苯乙烯的反应如下: ![]() (g)
(g) ![]()
![]() (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定.在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示.
已知:气体分压(p分)=气体总压(p总)×体积分数.
不考虑副反应,下列说法正确的是( )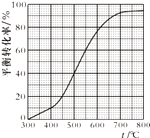
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= ![]() ×p总
×p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
【答案】C
【解析】解:A、向体积可变的密闭容器中通入水蒸气,导致反应体系体积变大,反应物和生成的浓度都减小,v(正)、v(逆) 均减小,相当于减小压强,平衡正向移动,所以乙苯转化率升高,故A错误;B、向体系中通入乙苯、苯乙烯、氢气各0.1x mol,相当于减小压强,平衡正向移动,而不是不移动,故B错误;
C、由图可知500℃时,乙苯的平衡转化率为:60%,应用三行式,
|
|
| H2(g) | |
初起量: | x mol | 0 | 0 | |
变化量: | 0.6xmol | 0.6xmol | 0.6xmol | |
平衡量: | 0.4xmol | 0.6xmol | 0.6xmol |
所以K= 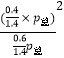 =
= ![]() ×p总 , 故C正确;
×p总 , 故C正确;
D、由图可知550℃时平衡体系中苯乙烯的转化率率为:60%,450℃时平衡体系中苯乙烯的转化率率为:20%,所以550℃时平衡体系中苯乙烯的体积分数是450℃时的2倍,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.27g Al3+所含离子数为3NA
B.11.2L氢气完全燃烧转移的电子数目为NA
C.常温常压下32g氧气所含的原子数目为2NA
D.标准状况下,22.4 L水中含有的水分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A.0.2mol/LNa2SO4溶液中含有Na+和SO42﹣总物质的量为0.6mol
B.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol/L
C.10g 98%的硫酸(密度为1.84gcm﹣3)与10mL 18.4mol/L的硫酸的浓度相同
D.50mL 2mol/LNaCl溶液和100 mL 0.5mol/LMgCl2溶液中,Cl﹣物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种新型锂﹣氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O ![]() 2I2+4LiOH
2I2+4LiOH
对于该电池的下列说法不正确的是( )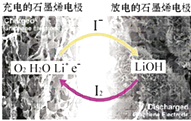
A.放电时负极上I﹣ 被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e﹣═Li+OH﹣
D.放电时正极反应为O2+2H2O+4Li++4e﹣═4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 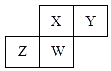
A.原子半径:Z>W>X>Y
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.ZY2晶体熔化、液态Y3气化均需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如图: 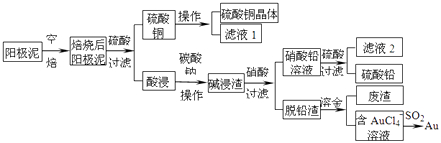
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb﹣2e﹣+SO42﹣=PbSO4和 .
(2)碱浸渣的主要成分是、 . (写化学式)
(3)操作I的主要步骤为 .
(4)写出用SO2还原AuCl4﹣的离子方程式 .
(5)为了减少废液排放、充分利用有用资源,工业上将滤液2并入硝酸进行循环操作,请指出流程图中另一处类似的做法 .
(6)已知298K时,Ksp(PbCO3)=1.5×10﹣13 , Ksp(PbSO4)=1.8×10﹣8 , 将1mol PbSO4固体放入1L Na2CO3溶液中,充分反应后达到平衡,溶液中c(CO32﹣)为5mol/L,溶液体积在反应前后保持不变,则平衡后c(SO42﹣)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com