
| ||
| ||
| 11.2L |
| 22.4L/mol |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
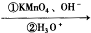 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 |
| C、0.1 mol?L-1与0.2 mol?L-1氨水溶液中c(OH-)之比为1:2 |
| D、中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、加入0.1mol/L 的醋酸溶液100mL |
| C、加入少量的0.5mol/L的硫酸 |
| D、加入少量1mol/L 的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是分解反应 |
| B、是氧化还原反应 |
| C、反应中碳元素的化合价降低 |
| D、氧化剂是C2H3N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
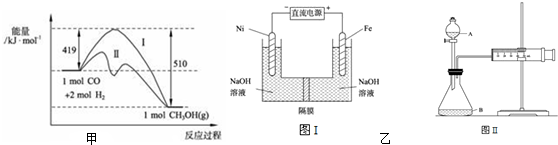
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn |
| B、碳棒 |
| C、MnO2和NH4+ |
| D、Zn2+和NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com