
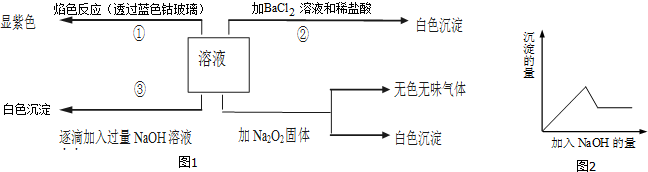


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
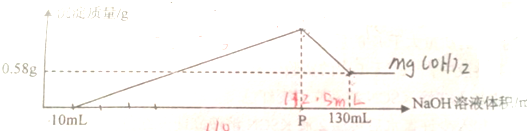
| A、盐酸的物质的量浓度为0.22mol/L |
| B、混合物中Al2O3的物质的量为0.01mol |
| C、混合物中MgO的物质的量为0.01mol |
| D、P点加入NaOH溶液的体积是110mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
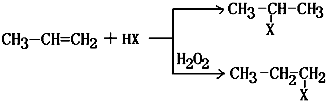 (X)为卤素原子
(X)为卤素原子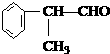 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
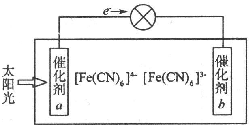 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、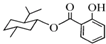 的分子式为C17H24O3 的分子式为C17H24O3 |
| B、水溶液中氨基酸在等电点时的溶解度最小.不同的氨基酸达到等电点的pH不同,故可以通过调节溶液pH分离某些氨基酸 |
C、有机硅聚醚(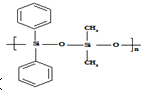 )可由单体 )可由单体 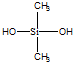 和 和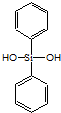 缩聚而成 缩聚而成 |
| D、等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:
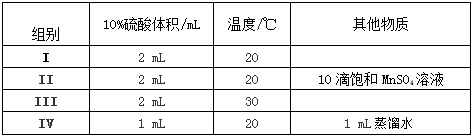
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com