
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.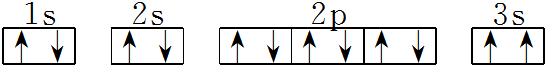 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,核外电子排布式为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素;G在第四周期周期表的第7列,G为Mn元素.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,核外电子排布式为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素;G在第四周期周期表的第7列,G为Mn元素.
(1)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为 ,
,
故答案为: ;
;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈哑铃形,
故答案为:3,哑铃;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为 ,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)G为Mn元素,核外电子排布式为1s22s22p63s23p63d54s2,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,
故答案为:ⅦB;d;1s22s22p63s23p63d54s2;
(5)检验K元素的实验方法是:焰色反应,
故答案为:焰色反应.
点评 本题考查结构性质与位置关系、核外电子排布规律、电离能等,难度中等,推断元素是解题的关键,注意基础知识的掌握.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液质童增加6.4g | B. | 阴极质量增加6.4g | ||
| C. | 阴极增加的质量小于6.4g | D. | 溶液中Cu2+浓度完全保持不变. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 KCl | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 NaOH 稀硫酸 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

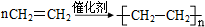 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐加碘所添加的是碘酸钾 | |
| B. | 油脂既能为人体提供热量,又能提供人体必需脂肪酸 | |
| C. | 棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 | |
| D. | 蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com