
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
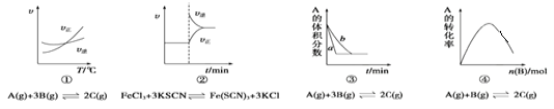
A.①是其他条件一定时,反应速率随温度变化的图像,则逆反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率变化的图象
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】已知X的性质与乙酸乙酯相似,是一种具有果香味的合成香料,下图为合成X的某种流程:
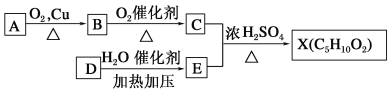
提示:①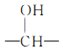 不能最终被氧化为—COOH;
不能最终被氧化为—COOH;
②D的产量可以用来衡量一个国家的石油化工水平。
请根据以上信息,回答下列问题:
(1)A分子中官能团的名称是__________,E的结构简式是________。
(2)D→E的化学反应类型为________反应。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是________。
(4)C的一种同分异构体F可以发生水解反应,则F的结构简式为_________________。
(5)反应C+E→X的化学方程式为_____________________________________________。
(6)为了制取X,甲、乙、丙三位同学分别设计下列三套实验装置:
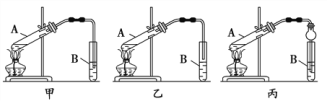
请从甲、乙两位同学设计的装置中,选择一种作为实验室制取X的装置,选择的装置是_______(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是_______。试管B中放入的是饱和________溶液,从试管B中分离出X所用的主要仪器是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法正确的是( )
A.已知K=![]() ,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)
,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小
C.常温下,向纯水中加入碳酸钠,水的电离程度变大,Kw变大
D.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中:K+、Na+、CO![]() 、AlO2-
、AlO2-
C. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D. 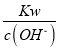 =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___K。
II.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___。
(2)反应前A的物质的量浓度是___。
(3)10s末,生成物D的浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 | H2CO3 |
电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
(1)上表的6种酸进行比较,酸性最弱的是:___;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是___。
II.已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=___。
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是__溶液。
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是___溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液___;NH4Cl溶液__。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol·L-1(填“>”、“<”或“=”),![]() __(填“增大”、“减小”或“不变”)
__(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示溶液中发生反应的化学方程式错误的是
A. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B. KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_______________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。

当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定: Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式______________________。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:______________________。
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为_____________mol·L-1用含字母的代数式表示)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,该反应的氧化产物是___________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com