
| A. | 从1L 1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol•L-1 | |
| B. | 物质的量是指物质所含微粒的数目 | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 冰水混合物既是纯净物又是化合物 |
分析 溶液为均一、稳定的分散系,根据n=CV=$\frac{N}{{N}_{A}}$结合物质的构成计算该题.
解答 解:A.溶液为均一、稳定的分散系,则从1L 1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol•L-1,故A正确;
B.物质的量一定数目粒子的集合体,单位为摩尔,不表示数目,故B错误;
C.0.5 L 2 mol•L-1的氯化钡溶液中,钡离子为1mol,氯离子为2mol,共3mol,个数为3×6.02×1023,故C正确;
D.冰水混合物都有水构成,仅是状态不同,为纯净物,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的量的计算、物质的分类等知识,注意把握相关概念以及物质的构成特点,难度不大.


科目:高中化学 来源: 题型:实验题
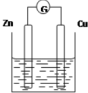 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成该晶体的微粒为分子 | |
| B. | 1mol该晶体中有2mol共价键 | |
| C. | 该二氧化碳晶体和干冰存在的作用力完全相同 | |
| D. | 一定条件下该晶体能与氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CO2+C(红热)═2CO | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空:
人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空: ;该分子的空间构型为正四面体结构.
;该分子的空间构型为正四面体结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2(g)═SO2(g);△H1 S(g)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com