
科目:高中化学 来源: 题型:
A、B、C、D为短周期元素,A、B同周期,C、D同主族,已知A的阳离子与D的阴离子具有相同的电子层结构,B的阴离子和C的阴离子电子层结构相同,且C离子的核电荷数大于B离子的,则4种元素的电负性顺序正确的是( )
A.A>B>C>D B.D>C>B>A
C.C>D>B>A D.A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤H2O2、⑥NH4Cl、⑦NaOH、⑧Ar、⑨CO2、⑩C2H4
(1)只存在非极性键的分子是__________;既存在非极性键又存在极性键的分子是__________;只存在极性键的分子是__________。
(2)只存在单键的分子是__________,存在三键的分子是__________,只存在双键的分子是__________,既存在单键又存在双键的分子是__________。
(3)只存在σ键的分子是__________,既存在σ键又存在π键的分子是__________。
(4)不存在化学键的是__________。
(5)既存在离子键又存在极性键的是__________;既存在离子键又存在非极性键的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H和O可以形成H2O和H2O2两种化合物,试根据有关信息完成下列问题:
(1)水是维持生命活动所必需的一种物质。
①1 mol冰中有________mol氢键。
②用球棍模型表示的水分子结构是____________。


(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。
试回答:
①H2O2分子的电子式是______________,结构式是________________________________________________________________________。
②H2O2分子是含有________键和________键的__________(填“极性”或“非极性”)分子。
③H2O2难溶于CS2,简要说明理由:________________________________________________________________________
________________________________________________________________________。
④H2O2中氧元素的化合价是__________,简要说明原因
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是__________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛(H2C===O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为________,甲醇分子内的O—C—H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O—C—H键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力不涉及____________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键
e.氢键 f.范德华力
(4)已知苯酚(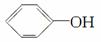 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子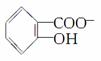 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_________________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:________________________________________________________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.第ⅤA族与第ⅦA族的短周期元素的原子间构成的所有分子,其原子均满足最外层8电子结构
B.第ⅠA族元素单质熔沸点随着核电荷数的递增而升高
C.因为F的非金属性强于Cl的,所以HF的酸性强于HCl的
D.离子半径:r(S2-)>r(O2-)>r(Na+)>r(Al3+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com