

| A. | M是直流电的正极 | B. | 电子流向是N→b→a→M | ||
| C. | 电解过程中,水是氧化剂 | D. | b电极附近溶液的pH变小 |
分析 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极负极先产生了Cl2,漂白pH试纸变白,后OH-离子放电产生氧气,H+相对剩余呈酸性,使pH试纸外圈呈红色,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O-4e-═H2↑+2OH-,据此分析解答.
解答 解:a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极负极先产生了Cl2,漂白pH试纸变白,后OH-离子放电产生氧气,H+相对剩余呈酸性,使pH试纸外圈呈红色,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O-4e-═H2↑+2OH-,
A.外圈呈浅红色,说明溶液显碱性,因此a电极是阴极,氢离子放电,所以M是电源的负极,故A不选;
B.电子从负极流向阴极、从阳极流向正极,所以电子流向是N→b、a→M,电子不进入溶液,故B选;
C.电解过程中,水得电子生成氢气,则水是氧化剂,故C不选;
D.b电极方程式为2H2O-4e-═H2↑+2OH-,溶液碱性增强,溶液的pH增大,故D选;
故选BD.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,正确判断正负极、阴阳极是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液中阴阳离子通入定向移动形成电流,题目难度不大.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
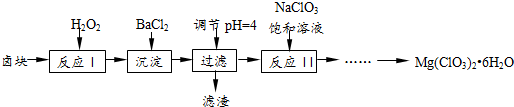
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
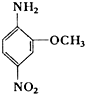 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )| A. | 6种 | B. | 7种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
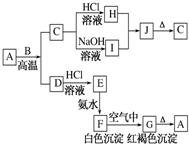 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.
有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.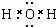 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com