
| A. | 1mol氯化钾含有6.02×1023个KCl分子 | |
| B. | 6.02×1024个CO2分子的物质的量是1mol | |
| C. | 1molN2O4含有1molN2分子和4molO原子 | |
| D. | 1molH2分子和1molH2O分子所含的氢原子数相等 |
科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 | |
| C. | 铁在氧气中燃烧生成氧化铁,镁在空气中燃烧生成氧化镁、氮化镁 | |
| D. | 针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
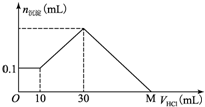 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )| A. | 70 mL | B. | 100 mL | C. | 120 mL | D. | 130 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{44}$mol-1 | B. | $\frac{x}{22}$mol-1 | C. | $\frac{3x}{44}$mol-1 | D. | $\frac{44x}{3}$mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
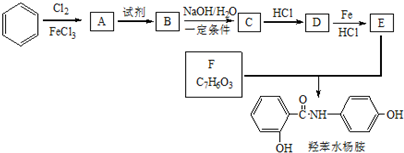
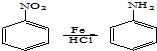
 .
. 、
、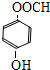 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
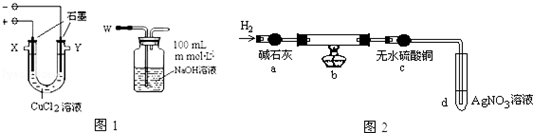
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com