
 四川盛产五倍子.以五倍子为原料可以制得化合物A.A的结构简式如图所示:请回答下列问题:
四川盛产五倍子.以五倍子为原料可以制得化合物A.A的结构简式如图所示:请回答下列问题: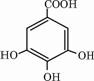 ,发生酯化反应生成A,故答案为:
,发生酯化反应生成A,故答案为: ;
; ,
, ;
; ,与溴发生加成反应的方程式为
,与溴发生加成反应的方程式为 ,
, .
.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、同周期元素的离子中W离子半径最小 |
| B、元素X能与元素Y形成共价化合物X2Y2 |
| C、工业上用二氧化锰和浓盐酸制取Q的单质 |
| D、元素Z、W、R的最高价氧化物对应的水化物之间均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
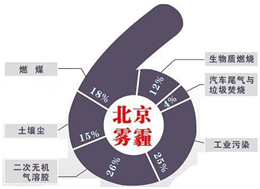 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
| ||
| ||
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
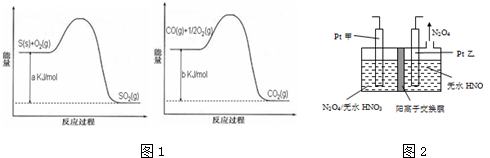
 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
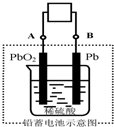 电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | ≥3~4 |
A、混合溶液中:c(SO
| ||
| B、若向混合溶液中加入铁粉,不可能观察到红色固体析出 | ||
| C、若向混合溶液中加入足量氯水,调节pH到3-4后过滤,得到纯净的CuSO4溶液 | ||
| D、若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水的阳极反应:2H2O+2e-=H2↑+2OH- | ||
B、碳酸钠溶液呈碱性的原因:CO
| ||
C、向AgNO3溶液中加入过量氨水:Ag++NH3?H2O=AgOH↓+NH
| ||
D、泡沫灭火器反应原理:A12++3HCO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com