
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:阅读理解

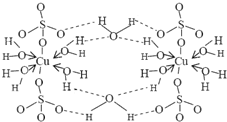


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | B、P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | C、IA族的金属单质与水反应比同周期IIA族的金属单质剧烈 | D、除稀有气体外,第三周期元素的原子半径和离子半径随原子序数的增加而减小 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省金昌市第一中学高一期中考试(理)化学试卷 (带解析) 题型:填空题
(13分)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
| A.③、④处于不同周期 |
| B.⑥在同主族元素中非金属性最强 |
| C.⑤元素与⑦元素两者核电荷数之差是8 |
| D.①与⑧形成的化合物只含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com