
【题目】ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
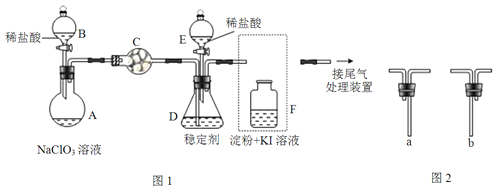
(1)仪器C的名称是__。安装F中导管时,应选用图2中的__。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.该反应中氧化剂与还原剂物质的量之比为__,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___。
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__,原因是__。
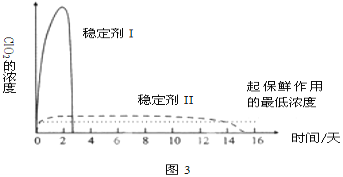
【答案】干燥管 b 1:1 慢 吸收Cl2 4H++5ClO2-=Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
【解析】
ClO2与Cl2的氧化性相近,稀盐酸和NaClO3溶液发生反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,生成ClO2和Cl2气体进入干燥管中,D中加入稳定剂使ClO2在D中被稳定剂充分吸收。
(1)根据仪器特征,仪器C的名称是干燥管;根据操作分析,F装置应是Cl2和KI反应,所以应该长管进气,短管出气,答案选b。
(2)根据反应方程式可知,NaClO3中氯元素化合价由+5价降低到+4价,HCl中氯元素化合价由-1价升高到0价,故NaClO3作氧化剂,HCl作还原剂,根据得失电子守恒可知,氧化剂与还原剂物质的量之比为1:1;为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢。
(3)F装置中能发生Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以若F中溶液的颜色若不变,说明没有氯气,则装置C的作用是吸收Cl2。
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据化合价升降相等和电荷守恒以及原子守恒配平,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成。
(5)根据图3可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下进行反应:COCl2(g)![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A.0~4s容器内的压强逐渐增大
B.生成Cl2的平均反应速率,0~2s比2~4s快
C.8s时向容器中再充入一定量的氦气,反应速率又会加快
D.该条件下,COCl2的最大转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某煤发电厂处理废气的装置示意图。下列说法错误的是( )

A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为2SO2+2CaCO3+O2===2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin )又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去)如图所示

回答下列问题
⑴A的名称为______,F中官能团名称为________、________。
⑵B的结构简式为_____。③的反应类型为_____,⑧的反应类型为_____。
⑶在一定条件下l mol 的华法林最多反应_______molH2
⑷写出由C 生成 D 的化学方程式为 ___________;
⑸F的同分异构体甚多,满足下列条件:①属芳香族化合物②发生银镜反应③和NaOH溶液反应,共___种,其中遇氯化铁显紫色且苯环上的一氯代物只有两种结构的结构简式_________。
⑹若D为乙醛,按框图中④同样的反应物和条件,写出生成物的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中所含晶体FeSO47H2O的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.2000molL-1KMnO4溶液20.00mL,所得晶体中FeSO47H2O的质量分数为__(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用热化学方程式表示:
①1mol N2(g)与适量O2(g)起反应,生成2 mol NO2(g),吸收68kJ热量。___________
②4g CO在氧气中燃烧生成CO2,放出9. 6kJ热量_____________________________________
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为_________________________________________________。
②又已知![]() ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是( )
A.NH4Cl的水解常数表达式:![]()
B.NaHCO3水解的离子方程式:HCO3- + H2O ![]() H3O + + CO32-
H3O + + CO32-
C.结构示意图为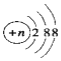 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.H2SO3的电离方程式:H2SO3![]() 2H+ + SO32-
2H+ + SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com