
分析 根据n(KCl):n(CaCl2)=n(K+):n(Ca2+)计算物质的量之比,根据m=nM计算质量关系,进而计算质量分数.
解答 解:由KCl与CaCl2的化学式可知:n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:3,
设KCl为2mol,则CaCl2为3mol,
则m(KCl)=2mol×74.5g/mol=149g,m(CaCl2)=3mol×111g/mol=333g,该混合物中CaCl2的质量分数:$\frac{333g}{333g+149g}$×100%=69.1%;
由KCl与CaCl2的化学式可知:n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:3,设氯化钾物质的量为2xmol,则氯化钙物质的量为3xmol,依据题意可知:2x+3x×2=8x=1mol,解得x=0.125mol,则KCl的物质的量为0.125mol×2=0.25mol,质量为;0.25mol×74.5g/mol=18.625g;
故答案为:69.1%;18.625g;
点评 本题考查学生利用以物质的量为中心的计算公式进行简单计算,明确质量、体积、物质的量的关系即可解答,并注意水在标准状况下为液体来解答.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清的石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水溶液:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 在CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 氧化钠投入水中:O2-+H2O-═2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
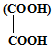
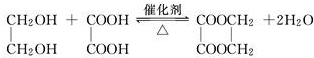 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
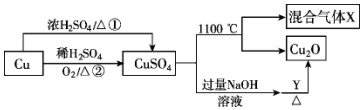
| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | 硫酸铜在1100℃分解所得气体X可能是二氧化硫和三氧化硫的混合气体 | |
| C. | Y可以是葡萄糖溶液 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶可制得胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两种互不相溶的液体,如汽油和水,可通过分液方法分离 | |
| B. | 因为碘易溶于酒精,所以常用酒精萃取碘水中的碘 | |
| C. | 观察钾元素焰色反应的操作:先将铂丝放在稀硫酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的外焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| D. | 将饱和FeCl3溶液滴入沸水中可得Fe(OH)3胶体,区别溶液和胶体的方法是丁达尔效应 | |
| E. | 分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体 | |
| F. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| G. | 为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,最后加盐酸后过滤 | |
| H. | 在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | W克该原子的物质的量一定是$\frac{W}{a{N}_{A}}$ mol | |
| C. | W克该原子中含有$\frac{W}{b}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
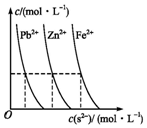 平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.
平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com