
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,在水中的溶解度:Na2CO3<NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 都能与足量盐酸反应放出CO2,且产生气体的物质的量相同 | |
| D. | 与相同浓度的盐酸反应放出CO2的速率Na2CO3大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
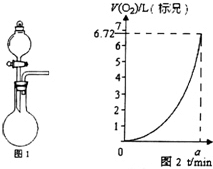 某同学探究KMnO4溶液和H2O2的反应.
某同学探究KMnO4溶液和H2O2的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子的百分数不一定增大,但是化学反应速率一定增大 | |
| B. | 在化学反应前后催化剂的化学性质不变,但是由于参与化学反应导致质量减小 | |
| C. | 使用正催化剂,能降低化学反应的活化能,增大活化分子的百分数,化学反应速率一定增大 | |
| D. | 活化分子发生碰撞即可发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com