
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
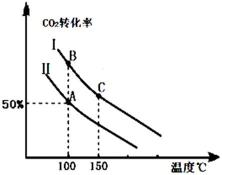
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.分析 Ⅰ.(1)由图可知,投料比相同时,温度越高,二氧化碳的转化率越低,说明平衡向逆方向移动正方向为放热反应;
(2)①相同温度下,固定容器中增大氨气的量,可提高二氧化碳的转化率,由图可得出投料比的大小;
②根据A点二氧化碳的转化率计算出平衡时体系中气体总物质的量,利用物质的量之比等于压强之比解答;
③温度相同,平衡常数相同;温度越高,反应速率越大;
(3)按曲线Ⅰ的投料比投料,压缩容器体积,平衡向气体体积缩小的方向移动,即正方向移动,二氧化碳的转化率增大,则在相同温度下,二氧化碳的转化率同等程度高于投料Ⅰ,由此平滑的画出曲线;
(4)平衡正向移动可提高二氧化碳的转化率;
Ⅱ.NH4NO3溶于水,水解促进水的电离,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将受到抑制;向该溶液中滴加1L稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,设平衡时NH3•H2O的物质的量为x,溶液的体积为1L,根据电离平衡常数的定义计算.
解答 解:Ⅰ.(1)由图可知,投料比相同时,温度越高,二氧化碳的转化率越低,说明平衡向逆方向移动,逆方向为吸热反应,正方向为放热反应,△H<0,则a<0,
故答案为:<;投料比相同时,温度越高,二氧化碳的转化率越低,说明平衡向逆方向移动,正方向为放热反应;
(2)①相同温度下,投料Ⅰ时CO2的转化率高,投料Ⅱ的转化率低,在固定容器中增大氨气的量,可提高二氧化碳的转化率,说明反应物投料比$\frac{n(C{O}_{2})}{n(N{H}_{3})}$是Ⅰ中的小,
故答案为:<;
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.4,则n(NH3)=$\frac{10mol}{0.4}$=25mol,达到平衡A点时,二氧化碳的转化率为50%,则有三行式:
2NH3(g)+CO2(g)═CO(NH2)2(l)+H2O(g)
起始量:25mol 10mol 0mol 0mol
改变量:10mol 5mol 5mol 5mol
平衡量:15mol 5mol 5mol 5mol
则平衡时气体总物质的量为25mol,起始气体总物质的量为35mol,则A点与起始压强比=物质的量之比,即$\frac{25mol}{35mol}$=$\frac{5}{7}$,
故答案为:5:7;
③A点和B点的温度相同,所以平衡常数相同;C点的温度更高,所以C点正反应速率比B点的正反应速率高,
故答案为:=;<;
(3)按曲线Ⅰ的投料比投料,压缩容器体积,平衡向气体体积缩小的方向移动,即正方向移动,二氧化碳的转化率增大,则在相同温度下,二氧化碳的转化率同等程度高于投料Ⅰ,由此平滑的画出曲线: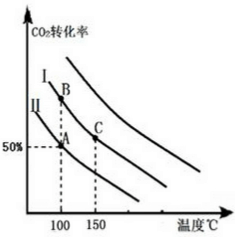 ,
,
故答案为: ;
;
(4)a.使用催化剂,平衡不移动,不能提高二氧化碳的转化率,故a错误;
b.及时从体系中分离出部分CO(NH2)2,尿素的浓度不变,平衡不移动,不能提高二氧化碳的转化率,故b错误;
c.将体系中的水蒸气液化分离,减小生成物浓度,平衡正向移动,提高了二氧化碳的转化率,故c正确;
故答案为:c;
Ⅱ.NH4NO3溶于水,溶液显酸性,是铵根的水解引起:NH4++H2O?NH3•H2O+H+,水解促进水的电离,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将受到抑制,即逆向移动,向该溶液中滴加1L稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,
设平衡时NH3•H2O的物质的量为x,溶液的体积为1L,
则:NH3•H2O?NH4++OH-
平衡时的浓度(mol/L ):x 10 10-7
由电离平衡常数可知:$\frac{10×1{0}^{-7}}{x}$=2×10-5,x=0.05,
故答案为:逆向;0.05.
点评 本题考查化学平衡的影响因素以及弱电解质的电离平衡等知识,综合性较强,需要扎实的基础知识和灵活解决问题的能力,注意三段式解题法的运用.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古人利用明矾溶液的酸性来清洗青铜器上的铜锈 | |
| B. | 人体摄入适量的油脂有利于促进维生素的吸收 | |
| C. | 《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,所述过程不涉及化学变化 | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com