
目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
|
| A. | SO2(氧化物) | B. | 碘酒(单质) | C. | HNO3(含氧酸) | D. | 氯水(混合物) |
考点:
酸、碱、盐、氧化物的概念及其相互联系;混合物和纯净物.
专题:
物质的分类专题.
分析:
根据物质的组成进行分析,氧化物是指由两种元素组成,其中一种是氧元素的化合物,单质是由一种元素构成的纯净物,水溶液中电离生成的阳离子全部是氢离子的化合物是酸若含有氧元素则为含氧酸,混合物是指由多种物质组成的物质
解答:
解:A、是由氧元素和硫元素组成的化合物属于氧化物,故A正确;
B、碘酒是酒精和碘单质的混合物,不是单质,故B错误;
C、硝酸属于含氧酸,故C正确;
D、氯水是氯气溶于水形成的混合物,故D正确;
故选B.
点评:
本题是一道有关物质的分类的题目,熟记各种类型的物质的概念是解题的关键,属于基础知识的考查.


科目:高中化学 来源: 题型:
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性.
|
| A. | ①④⑤ | B. | ①⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有( )
A. 5种、10种、15种 B. 8种、18种、18种
C. 8种、10种、15种 D. 9种、10种、15种
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液只含有Na+,Al3+,Cl﹣,SO42﹣四种离子,已知Na+,Al3+,Cl﹣的个数比为3:2:1.则溶液中Al3+与SO42﹣离子的个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学和材料开发制造、科学研究、生产生活等密切相关.
(1)第十八届江苏省运动会于2014年9月19日在徐州奥体中心开幕,奥体中心建筑采用了世界领先的钢结构技术,建筑材料中还使用了大量的铝合金、玻璃等.
①工业上铁的冶炼是在 中进行的,主要原料有铁矿石,焦炭、空气、 等.
②下列有关铝合金性能的叙述正确的是 c (填字母).
a.密度大 b.强度小 c.耐腐蚀
③下列物质中,不是工业上制造玻璃的主要原料的是 (填字母).
a.水玻璃 b.二氧化硅 c.碳酸钠
(2)化工生产和科学研究中,经常需要配制一定物质的量浓度的溶液.
①在实验室,使用容量瓶来准确配制 、一定浓度的溶液.
②欲配制1.00mol/L的氯化钠溶液100mL,用不到的仪器是 (填“烧杯”、“玻璃棒”或“分液漏斗”).配制500mL0.l mol/L氢氧化钠溶液需要氢氧化钠的质量是 g.
③在溶液稀释前后,溶液的体积发生了变化,但溶液中 的物质的量不变.配制一定物质的量浓度的Na2CO3溶液时,下列操作正确的是 (填字母).
a.将称好的固体在烧杯中溶解,所得溶液冷至室温再转移到容量瓶中
b.定容时,如果加水超过了刻度线,用胶头滴管直接吸出多余的部分
c.定容摇匀后发现溶液液面低于刻度线,再补加少量蒸馏水至刻度线
(3)物质的结构决定物质的性质,物质的性质关系到物质的用途.
①以电解 为基础制备氯气等产品的工业称为氯碱工业.在实验室要将氯化钠溶液和氯化钾溶液区别开来,可以采用的方法是 .
②当分散剂是水或其他液体时,根据 直径大小的不同,可以将分散系分为浊液、胶体和溶液.在实验室区分胶体与溶液常用的一种物理方法为 .
③在生产中,人们曾用浓氨水来检验氯气管道是否漏气.如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,其化学键类型完全相同的是( )
|
| A. | HCl 和KCl | B. | NH3 和H2O | C. | SiO2 和NaCl | D. | CO2 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
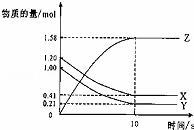
|
| A. | 反应开始到10s,用Z表示的反应速率为 0.158mol/(L•s) |
|
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L |
|
| C. | 反应开始到10s时,Y的反应速率为0.0395mol/(L•s) |
|
| D. | 反应的化学方程式为:X(g)+Y(g)⇌Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
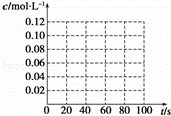
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).
查看答案和解析>>
科目:高中化学 来源: 题型:
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:正确的操作顺序是( )
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤.
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com