
X”¢Y”¢Z”¢W”¢RŹōÓŚ¶ĢÖÜĘŚŌŖĖŲ£¬ŅŃÖŖĖüĆĒ¶¼²»ŹĒĻ”ÓŠĘųĢåŌŖĖŲ£¬XŌ×Ó°ė¾¶ŹĒĖłŹōÖÜĘŚÖŠ×ī“ó£¬YŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżĪŖm£¬“ĪĶā²ćµē×ÓŹżĪŖn£¬ZŌŖĖŲµÄŌ×ÓL²ćµē×ÓŹżĪŖm£«n£¬M²ćµē×ÓŹżm£n£¬WŌŖĖŲÓėZŌŖĖŲĶ¬Ö÷×壬RŌŖĖŲŌ×ÓÓėYŌŖĖŲŌ×ÓµÄŗĖĶāµē×ÓŹżÖ®±ČĪŖ2”Ć1”£ĻĀĮŠŠšŹöÖŠ£¬“ķĪóµÄŹĒ
A. YµÄ×ī¼ņµ„Ēā»ÆĪļ±ČRµÄĪČ¶Ø£¬YµÄ×ī¼ņµ„Ēā»ÆĪļ·Šµć±ČRµÄøß
B. XÓėYŠĪ³ÉµÄĮ½ÖÖ»ÆŗĻĪļÖŠŅõ”¢ŃōĄė×ÓµÄøöŹż±Č¾łĪŖ1”Ć2
C. Z”¢W”¢R×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌĒæČõĖ³Šņ£ŗR£¾W£¾Z
D. YÓėZĮ½ÖÖŌŖĖŲ×é³É³£¼ūZY2ŠĶ·Ö×Ó

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚH2O2+Cl2=2HCl+O2·“Ó¦ÖŠ£¬ĆæÉś³É32gŃõĘų£¬Ōņ×ŖŅĘ4NAøöµē×Ó | |
| B£® | ŗ¬ÓŠNAøö”°Cu”±Ī¢Į£µÄCuOŗĶCu2S»ģŗĻĪļÖŹĮæĪŖ80g | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬2.24L CO2ŗĶSO2»ģŗĻĘųÖŠŃõŌ×ÓŹżĪŖ0.2NA | |
| D£® | 100mL0.1mol/LµÄNaClČÜŅŗÖŠ£¬Ėłŗ¬Ī¢Į£×ÜŹżĪŖ0.02NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČżÉĻѧʌʌ֊»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²śÉś»īÖŠÓ¦ÓĆ¹ć·ŗ£¬Ēė½ā¾öĻĀĮŠĪŹĢā”£
£Ø1£©ĮņĖįĶČÜŅŗŹ±°×Į×ŅżĘšÖŠ¶¾µÄŅ»ÖÖ½ā¶¾¼Į£ŗ
P4+CuSO4+H2O Cu3P+H3PO4+H2SO4£¬Čō6molH3PO4Éś³É£¬Ōņ±»CuSO4Ńõ»ÆµÄP4µÄĪļÖŹµÄĮæĪŖ ”£
Cu3P+H3PO4+H2SO4£¬Čō6molH3PO4Éś³É£¬Ōņ±»CuSO4Ńõ»ÆµÄP4µÄĪļÖŹµÄĮæĪŖ ”£
£Ø2£©µŖµÄ»ÆŗĻĪļŗĻ³É”¢Ó¦ÓĆ¼°µŖµÄ¹Ģ¶ØŅ»Ö±ŹĒæĘѧъ¾æµÄČČµć”£ŅŌCO2ÓėNH3ĪŖŌĮĻŗĻ³É»Æ·ŹÄņĖŲµÄÖ÷ŅŖ·“Ó¦ČēĻĀ£ŗ
¢Ł2NH3(g£©£«CO2(g£©£½NH2CO2NH4(s£©£»¦¤H£½£159.47 kJ”¤mol£1
¢ŚNH2CO2NH4(s£©£½CO (NH2£©2(s£©£«H2O(g£©£»¦¤H£½a kJ”¤mol£1
¢Ū2NH3(g£©£«CO2(g£©£½CO(NH2£©2(s£©£«H2O(g£©£»¦¤H£½£86.98 kJ”¤mol£1
ŌņaĪŖ ”£
£Ø3£©ÓŅĶ¼±ķŹ¾Ź¹ÓĆŠĀŠĶµē¼«²ÄĮĻ£¬ŅŌN2”¢H2ĪŖµē¼«·“Ó¦Īļ£¬ŅŌHCl£NH4ClĪŖµē½āÖŹČÜŅŗÖĘŌģ³ö¼ČÄÜĢį¹©ÄÜĮ棬Ķ¬Ź±ÓÖÄÜŹµĻÖµŖ¹Ģ¶ØµÄŠĀŠĶČ¼ĮĻµē³Ų”£ĒėŠ“³öøƵē³ŲµÄÕż¼«·“Ó¦Ź½ ”£Éś²śÖŠæÉ·ÖĄė³öµÄĪļÖŹAµÄ»ÆѧŹ½ĪŖ ”£

£Ø4£©³£ĪĀĻĀ£¬Ļņ0.1mol/L°±Ė®ÖŠ¼ÓČėÉŁŠķN2O5£¬Ź¹ČÜŅŗÖŠc(NH3”¤H2O£©:c(NH4+£©=5£ŗ9,“ĖŹ±ČÜŅŗµÄpH= .(25”ꏱ£¬NH3”¤H2OµÄµēĄė³£ŹżKb=1.8”Į10-5£©
£Ø5£©SiO2ČÜÓŚĒā·śĖįŗóÉś³ÉŅ»ÖÖ¼«ĒæµÄ¶žŌŖĖįŗĶĖ®£¬¾·ÖĪöøĆĖįÓÉ3ÖÖŌŖĖŲ×é³É£¬ĘäÖŠ·śŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ79.17%”£ĒėŠ“³öSiO2ČÜÓŚĒā·śĖįµÄĄė×Ó·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČżÉĻѧʌʌ֊»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
25”ꏱ£¬ĻĀĮŠø÷ČÜŅŗÖŠÓŠ¹ŲĪ¢Į£µÄĪļÖŹµÄĮæÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ
A£®ŌŚ0.1mol”¤L£1Na2SČÜŅŗÖŠ£ŗ2c(Na£«£©>c(S2££©>c(HS££©>c(OH-£©
B£®Ņ»¶ØĮæµÄ(NH4£©2SO4ÓėNH3”¤H2O»ģŗĻĖłµĆµÄĖįŠŌČÜŅŗÖŠ£ŗc(NH4+£©<2c(SO42-£©
C£®Ļņ0.1mol”¤L£1ŃĪĖįÓė0.1mol”¤L£1K2CO3ČÜŅŗµČĢå»ż»ģŗĻ£ŗ
c(K£«£©£¾c(Cl££©£¾c(OH££©£¾c(HCO3££©£¾c(H£«£©
D£®Ļņ0.1mol”¤L£1Na2CO3ČÜŅŗŗĶ0.1mol”¤L£1NaHCO3ČÜŅŗµČĢå»ż»ģŗĻ£ŗ
c(Na£«£©=c(CO32££©+c(HCO3££©+c(H2CO3£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČżÉĻѧʌʌ֊»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®Ź¹ÓĆæÉŌŁÉś×ŹŌ“”¢ÓĆ³¬ĮŁ½ē¶žŃõ»ÆĢ¼Ģę“śÓŠ»śČܼĮ”¢×¢ÖŲŌ×ӵľ¼ĆŠŌ”¢²ÉÓƵĶÄÜŗÄÉś²ś¹¤ŅÕ¶¼·ūŗĻĀĢÉ«»ÆѧµÄĖ¼Ļė
B£®°±»łĖįŹĒČĖĢå±ŲŠčµÄÓŖŃųĪļÖŹ£¬Ę侧ĢåÖ÷ŅŖŅŌÄŚŃĪŠĪŹ½“ęŌŚ£¬µ÷½ŚČÜŅŗµÄpHæÉøıäĖüµÄČܽā¶Č
C£®ŹÆÓĶĮŃ½ā”¢ĆŗµÄĘų»Æ”¢Ļš½ŗĄĻ»Æ”¢ŗ£Ė®ÖĘĆ¾”¢“æ¼ī¾§Ģå·ē»Æ”¢ĻĖĪ¬ĖŲÖĘ»šĆŽµČ¹ż³ĢÖŠ¶¼°üŗ¬»Æѧ±ä»Æ
D£®PM2.5ŹĒÖø“óĘųÖŠÖ±¾¶Š”ÓŚ»ņµČÓŚ2.5Ī¢Ć×µÄæÅĮ£Īļ£¬Ņ²³ĘĪŖ”°ĻøæÅĮ£Īļ”±£¬PM2.5ŌŚæÕĘųÖŠÖ»ŠĪ³ÉĘųČܽŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½ĖÕŹ”øßČżÉĻѧʌŌĀæ¼Ņ»»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚ100”ꏱ£¬½«0.40mol¶žŃõ»ÆµŖĘųĢå³äČė2LĆܱÕČŻĘ÷ÖŠ£¬ĆæøōŅ»¶ĪŹ±¼ä¶ŌøĆČŻĘ÷ÄŚµÄµĆµ½Źż¾ŻČēĻĀ
Ź±¼ä(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A£®·“Ó¦æŖŹ¼20sÄŚŅŌ¶žŃõ»ÆµŖ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.00125mol”¤L£1”¤s£
B£®80sŹ±»ģŗĻĘųĢåµÄŃÕÉ«Óė60sŹ±ĻąĶ¬£¬±Č40sŹ±µÄŃÕÉ«Éī
C£®80sŹ±ĻņČŻĘ÷ÖŠ¼ÓČė0.32molŗ¤Ęų£¬Ķ¬Ź±½«ČŻĘ÷Ą©“óĪŖ4L£¬ŌņĘ½ŗā½«²»ŅʶÆ
D£®ČōĘšŹ¼Ķ¶ĮĻĪŖ0.20molN2O4£¬ĻąĶ¬Ģõ¼žĻĀ“ļĘ½ŗā£¬Ōņø÷×é·Öŗ¬ĮæÓėŌĘ½ŗāĢåĻµ¶ŌÓ¦ĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗÓ±±Ź”øßČżÉĻĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
1.52 gĶĆ¾ŗĻ½šĶźČ«ČܽāÓŚ50 mLĆܶČĪŖ1.40 g/mL”¢ÖŹĮæ·ÖŹżĪŖ63%µÄÅØĻõĖįÖŠ£¬µĆµ½NO2ŗĶN2O4µÄ»ģŗĻĘųĢå1120 mL(±ź×¼×“æö)£¬Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė1.0 mol/L NaOHČÜŅŗ£¬µ±½šŹōĄė×ÓČ«²æ³ĮµķŹ±£¬µĆµ½2.54 g³Įµķ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®øĆŗĻ½šÖŠĶÓėĆ¾µÄĪļÖŹµÄĮæÖ®±ČŹĒ2:1
B£®øĆÅØĻõĖįÖŠHNO3µÄĪļÖŹµÄĮæÅØ¶ČŹĒ14.0 mol/L
C£®NO2ŗĶN2O4µÄ»ģŗĻĘųĢåÖŠ£¬NO2 µÄĢå»ż·ÖŹżŹĒ80%
µÄĢå»ż·ÖŹżŹĒ80%
D£®µĆµ½2.54 g³ĮµķŹ±£¬¼ÓČėNaOHČÜŅŗµÄĢå»żŹĒ600 mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
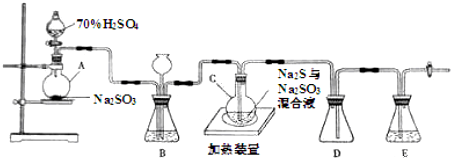
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com