
分析 (1)根据Fe元素守恒可知n(Fe3+)=2n(Fe2O3),据此计算15.014g该固体聚合物中Fe3+的物质的量;
(2)白色沉淀20.97g为BaSO4,而n(SO42-)=n(BaSO4),再根据电荷守恒计算n(OH-),然后利用质量守恒定律计算出结晶水的质量;
(3)y:z=n(OH-):n(SO42-),结合(2)的计算解答.
解答 解:(1)根据Fe元素守恒,15.014g该固体聚合物中Fe3+的物质的量为:n(Fe3+)=2n(Fe2O3)=$\frac{5.6g}{160g/mol}$×2=0.07 mol,
故答案为:0.07;
(2)白色沉淀20.97g为BaSO4,则n(SO42-)=n(BaSO4)=$\frac{20.97g}{233g/mol}$=0.09mol,
根据电荷守恒:n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.07mol-2×0.09mol=0.03mol,
15.014g该固体聚合物中,n(Fe3+)=0.07 mol,m(Fe3+)=0.07mol×56g/mol=3.92g,
n(SO42-)=0.09mol,m(SO42-)=0.09mol×96g/mol=8.64g,
n(OH-)=0.03mol,m(OH-)=0.03mol×17g/mol=0.51g,
则15.014g该固体聚合物中结晶水的质量为:m(H2O)=15.05g-3.92g-8.64g-0.51g=1.98g,
故答案为:1.98;
(3)根据(2)可知,n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.07mol-2×0.09mol=0.03mol,n(SO42-)=n(BaSO4)=$\frac{20.97g}{233g/mol}$=0.09mol,
Fex(OH)y(SO4)z•nH2O中y:z=n(OH-):n(SO42-)=0.03mol:0.09mol=1:3,
故答案为:1:3;y:z=n(OH-):n(SO42-)=0.03mol:0.09mol=1:3.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ”,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,写出它的分子式C12H24,当它发生一氯取代物时,能生成2种沸点不同的产物.
”,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,写出它的分子式C12H24,当它发生一氯取代物时,能生成2种沸点不同的产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素仅存在于矿物中 | |
| B. | 金属元素存在于矿物和动物体內,但植物体內不含 | |
| C. | 少数金属元素以游离态存在,大多数金属元素以化合态存在 | |
| D. | 金属元素仅存在矿物中,动物和植物体內也不存在金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
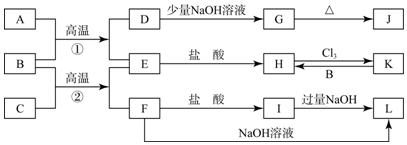
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 从蛇纹石组成看,其成皆是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸盐可用于制作光导纤维 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 明矾溶于水后会产生Al(OH)3胶体,可作为净水剂 | |
| D. | 液氨挥发时会吸收大量的热,可作为制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜、二氧化硫都是电解质 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com