
反应2SO2(g)+O2(g) 2SO3(g)经过一段时间后,SO3的浓度增加了
2SO3(g)经过一段时间后,SO3的浓度增加了
0.4 mol·L-1,测得在这段时间内用SO2的浓度变化表示的反应速率为
0.04 mol·L-1·s-1,则“这段时间”为( )
A.10 s B.5 s C.2.5 s D.0.1 s
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式为关于“亮菌甲素”的说法中,正确的是( )
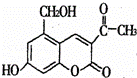
|
| A. | “亮菌甲素”在一定条件下可以与乙酸发生酯化反应 |
|
| B. | “亮菌甲素”的分子式为C12H12O5 |
|
| C. | 1mol“亮菌甲素”最多能和2mol NaOH反应 |
|
| D. | 1mol“亮菌甲素”最多能和4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
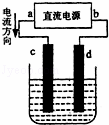
如图所示装置,c、d两极是石墨电极,回答下列问题:
(1)b是 极,c是 极;
(2)若电解质溶液是CuCl2,则c、d两电极的电极反应式是c: ,d: C ,检验c电极产物的方法是 ;
(3)若电解质溶液是滴有酚酞的饱和Na2SO4溶液,在恒定温度下电解一段时间后将直流电源拆除,在电解过程中除观察到两极上产生气泡外, 极附近溶液出现红色,将c、d用导线连接并接上电流计,发现电流计发生偏转,此时c电极发生的电极反应式是 ;
(4)若电解质溶液是CuSO4溶液,则c电极上发生的电极反应式是 ,随着电解的进行,溶液的pH将 (填“增大”、“减小”、“不变”),电解一段时间溶液仍为蓝色时停止电解,要使溶液回复到与电解前完全相同,此时应向溶液中加入 .
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式分别为:
CH4(g)+2O2(g)====CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1,
H2O(l)====H2O(g) ΔH=+44 kJ·mol-1;
则356 g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 ;
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为
;
(3)家用液化气中主要成分之一是丁烷。当1 g丁烷完全燃烧并生成CO2和液态水时,放出热量50 kJ。试写出丁烷燃烧的热化学方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的容积不变的密闭容器中,表明反应:
A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.每生成1 mol A时,消耗1 mol D
B.混合气体的密度不变
C.混合气体的压强不变
D.气体的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是( )
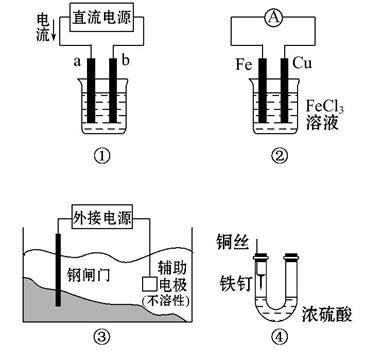
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应式是:Cu+2Fe3+====Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl﹣物质的量浓度相同的是( )
|
| A. | 100mL 0.5mol/L MgCl2溶液 |
|
| B. | 200mL 0.25mol/L AlCl3溶液 |
|
| C. | 50mL 1mol/L NaCl溶液 |
|
| D. | 25mL 0.5mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
|
| A. | 未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
|
| B. | 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
|
| C. | 铁制品应该连接在直流电源的负极 |
|
| D. | 镀锌层破损后即对铁制品失去保护作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com