
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( ) 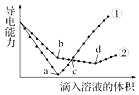
A.c点,两溶液中含有相同量的OH﹣
B.b点,溶液中大量存在的离子是Na+、OH﹣
C.①代表滴加H2SO4溶液的变化曲线
D.a、d两点对应的溶液均显中性
【答案】A
【解析】解:A.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4 , 因为硫酸根离子浓度相同,②中钠离子浓度大于①中氢离子浓度,所以溶液中氢氧根离子浓度不同,故A错误;B.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH,则大量存在的离子是Na+、OH﹣ , 故B正确;
C.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,即①代表滴加H2SO4溶液的变化曲线,故C正确;
D.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4 , 水和硫酸钠溶液都呈中性,故D正确;
故选A.


科目:高中化学 来源: 题型:
【题目】以下海带提碘的实验方案可以缩短实验时间,避免Cl2和CCl4的毒性.其实验流程如下: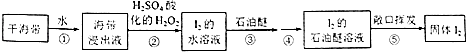
回答下列问题:
(1)步骤①的操作名称是;所需玻璃仪器有玻璃棒、烧杯和 .
(2)步骤②中加入H2O2后发生反应的化学方程式为;选择用H2O2做氧化剂的原因是 .
(3)检验I2的水溶液中含有单质碘的方法是,取样于试管中,加入淀粉,如溶液显色,则可证明含有碘单质.
(4)步骤③的操作名称是;石油醚能用作萃取剂,说明石油醚具有的性质是 .
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
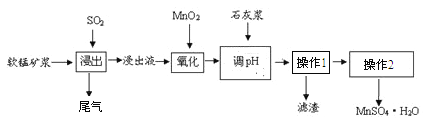
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.①②③
B.①②③④
C.①②③④⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( ) 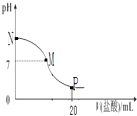
A.M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,恒压装置中N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1,。N2的平衡转化率(
2NH3(g) △H=-92.4kJ·mol-1,。N2的平衡转化率(![]() )与体系总压强(P)的关系如图所示。下列说法正确的是:
)与体系总压强(P)的关系如图所示。下列说法正确的是:

A. 平衡状态由A变到B时,平衡常数K(A)<K(B)
B. 上述反应在达到平衡后,充入He气,H2的转化率减小
C. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D. 将1mol氮气、3mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L Na2SO4溶液中含Na+ 4.6 g, 则溶液中SO42- 浓度为
A. 0.1mol/LB. 0.4mol/L
C. 0.6mol/LD. 0.2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com