
| A. | 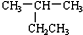 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH═CHCH3 丁烯 | ||
| C. | 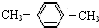 对二甲苯 对二甲苯 | D. | 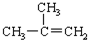 2-甲基-2-丙烯 2-甲基-2-丙烯 |
分析 A、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
B、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
C、苯的同系物的习惯命名法是用邻间对来表示侧链的位置关系;
D、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置.
解答 解:A、烷烃命名时,要选最长的碳链为主链,故主链上有4个碳原子,为丁烷,从离支链近的一端给主链上碳原子编号,则在2号碳原子上有一个甲基,故名称为2-甲基丁烷,故A错误;
B、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故此烯烃的名称为2-丁烯,故B错误;
C、此有机物中的两个甲基在对位,故为对二甲苯,故C正确;
D、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故名称为2-甲基-1-丙烯,故D错误.
故选C.
点评 本题考查了烷烃、烯烃和苯的同系物的命名,难度不大,应注意的是含官能团的有机物在命名时,选取主链和给主链编号时首先考虑官能团.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.
+HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
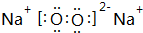 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
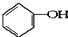 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
 的分子式:C6H6O
的分子式:C6H6O 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2SO4的酸性比HClO3酸性强 | |
| B. | Fe在纯氧中燃烧生成Fe3O4,Fe在氯气中燃烧生成FeCl3 | |
| C. | 在HClO中,元素化合价氯为+1价,氧为-2价 | |
| D. | O2为无色无味气体,Cl2为黄绿色有刺激性气味的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
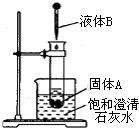 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:| 固体试剂A | 液体试剂B | |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N 2为0.2 mol•L-1,H 2为0.6 mol•L-1 | |
| B. | N 2为0.15 mol•L-1 | |
| C. | N 2、H 2均为0.18 mol•L-1 | |
| D. | NH 3为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com