
| A. | 0.1mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 0.3mol•L-1•min-1 | D. | 0.2mol•L-1•min-1 |
分析 10min内 v(N2)=$\frac{△c}{△t}$=$\frac{(1.8-0.8)mol/L}{10min}$=0.1mol/(L.min),同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,据此计算氨气的反应速率.
解答 解:10min内 v(N2)=$\frac{△c}{△t}$=$\frac{(1.8-0.8)mol/L}{10min}$=0.1mol/(L.min),同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,则v(NH3)=2 v(N2)=2×0.1mol/(L.min)=0.2mol/(L.min),故选D.
点评 本题考查化学反应速率的有关计算,侧重考查分析计算能力,明确反应速率与计量数关系即可解答,注意单位之间的换算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
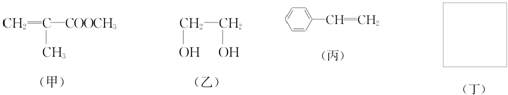
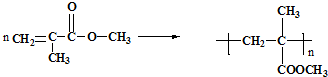
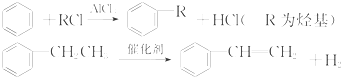 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$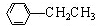 +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| D. | 向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的氢氧化铜沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n | B. | CH3CH2OH | C. | CH3COOH | D. | CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 遇FeCl3溶液呈紫色,且该物质与苯酚属于同系物 | |
| B. | 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2的物质的量分别为6mol和7mol | |
| D. | 该分子中的所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com