
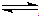
 Al(OH)3+3H+,
Al(OH)3+3H+, Al(OH)3+3H+,Al3+结合水微弱电离生成的OH-,使水的电离平衡向右移动,
Al(OH)3+3H+,Al3+结合水微弱电离生成的OH-,使水的电离平衡向右移动, BiOCl+2HCl,
BiOCl+2HCl, BiOCl+2HCl;
BiOCl+2HCl;

科目:高中化学 来源: 题型:
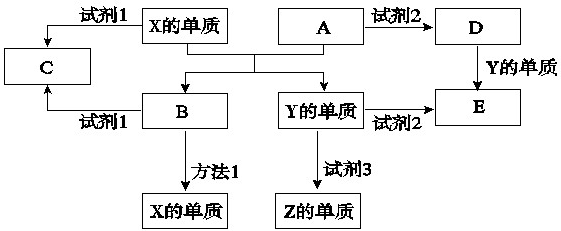
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | A | B | C |
| 初始浓度/mol?L-1 | 0.020 | 0.020 | 0 |
| 平衡浓度/mol?L-1 | 0.016 | 0.016 | 0.0080 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 步骤 | 试剂及操作 | 现 象 |
| i | 生成白色沉淀 | |
| ii | 向i所得溶液中滴加0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com