
在一定条件下,反应2HI(g)
 H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是 ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是 ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
A、①③⑥ B、③⑤⑥ C、①③⑤ D、②④⑤
科目:高中化学 来源: 题型:
某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀 ②检验CO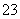 是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成 ③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度 ④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO
是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成 ③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度 ④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO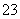 能100%转化为沉淀。其中正确的叙述是( )
能100%转化为沉淀。其中正确的叙述是( )
A.①② B.②③ C.①③④ D.都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
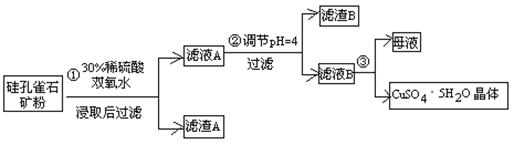
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
 Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
 Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)R2Cu
(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实,找出不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡: ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对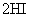

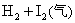 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应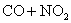

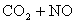 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应: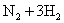

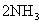 ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)  2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。
反应前各物质的物质的量/mol
A B C
甲 1 3 0
乙 0 0 2
丙 1.5 4.5 1
下列说法正确的是 ( )
A.乙中5 min内C的反应速率为0.16 mol·L-1·min-1
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲乙两容器中C的物质的量百分含量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.00 mol二氧化硫和1.00 mol氧气通入1.00 L的密闭容器中,分别在500 K,600 K,700 K三个不同的温度下进行2SO2+O2 2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.10 | 0.15 | 0.20 | 0.25 | 0.30 |
| 时间 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3浓度(mol·L-1) | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
表二:600 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.20 | 0.30 | 0.40 | 0.50 | 0.50 |
表三:700 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
(1)从上面三个表的数据可以判断该反应是__________反应(填“吸热”或“放热”),利用表一计算0~40 min内用SO2表示该反应的化学反应速率v(SO2)=__________mol·L-1·min-1。
(2)对该反应,下面的说法正确的是__________。
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500 K平衡状态时升高温度至600 K时,重新达到平衡状态时,容器的压强减小
(3)从上面三个表的数据,温度对该反应的反应速率和平衡移动的影响是_____________________________________________________________________。
(4)计算在600 K时的平衡常数(写出计算过程,最后结果取两位有效数字)。
(5)下图曲线(Ⅰ)是在500 K时SO3浓度的变化曲线,请你在图中画出在550 K进行上述反应的曲线,并标明曲线(Ⅱ)。
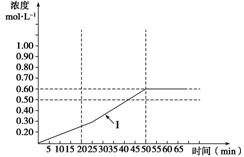
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于蛋白质的叙述正确的是 ( )
A.天然蛋白质的组成元素只有磷、氢、氧、氮
B.加热会使蛋白质变性,因此食生鸡蛋的营养价值更高
C.向鸡蛋中加食盐,会使蛋白质凝固变性
D.用一束光照射蛋白质溶液,可以产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2(g) 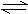 2NO(g)+O2(g)在体积固定的密闭容器中进行,能判断达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,能判断达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②生成O2的速率等于生成NO2的速率
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B .②③⑤ C.①③④⑤ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com