
【题目】Q、X、Y、Z、W五种元素的原子序数依次增大,Y、Z、W的核外电子数成等差数列。已知:①Q原子的最外层电子数是次外层电子数的2倍;②Y、Z同主族,Y原子的价电子排布图为![]() 。
。
请回答下列问题:
(1)基态Q原子中,核外电子共占据了________个轨道,电子占据的最高能级符号为________,该能级被电子填满时还需要________个电子。
(2)W的元素名称为________,其基态原子的电子排布式为________。
(3)Y分别与Q、Z形成的两种三原子分子的立体构型分别为________、________;对应的中心原子的杂化类型为________、________。
(4)Q、X、Y三种元素的第一电离能按由大到小的顺序是________(填元素符号,下同),电负性由大到小的顺序为________。
【答案】4 2p 4 铬 [Ar]3d54s1或1s22s22p63s23p63d54s1 直线型 V型 sp sp2 N>O>C O>N>C
【解析】
Q、X、Y、Z、W五种元素的原子序数依次增大,Q原子的最外层电子数是次外层电子数的2倍,则Q是碳(C);Y原子的价电子排布图为![]() ,则Y是氧(O);又Y、Z同族,则Z是硫(S);X是氮(N),Y、Z、W的核外电子数成等差数列,则W是24号元素铬(Cr)。
,则Y是氧(O);又Y、Z同族,则Z是硫(S);X是氮(N),Y、Z、W的核外电子数成等差数列,则W是24号元素铬(Cr)。
(1)基态C原子的核外电子排布式为1s2s22p2,2p能级占据两个轨道,共占据4个轨道;最高能级符号是2p;2p能级全部填满还需4个电子;
(2)W是24号铬元素;基态电子排布遵循能量最低原理,故核外电子排布式为:[Ar]3d54s1或1s22s22p63s23p63d54s1;
(3)氧和碳形成三原子分子CO2,采取sp杂化,呈直线型;氧和硫形成三原子分子SO2,采取sp2杂化,含一对孤对电子,呈V型;
(4)第一电离能指气态中性原子失去最外层一个电子变成气态离子所需要的能量,N元素2p能级半满,较稳定,大于O元素,故第一电离能按由大到小的顺序是N>O>C;电负性是指原子对电子的吸引能力,C、N、O三者电负性由大到小的顺序为O>N>C。


科目:高中化学 来源: 题型:
【题目】磁性材料A是一种二元化合物,某研究小组按如图流程探究其组成,已知E是一种能够漂白品红的气体,亦能使酸性KMnO4溶液褪色。请回答:

(1)某同学取少量溶液C于一支试管,加入______(填化学式)试剂无现象,可证明固体B无杂质。
(2)A的化学式为:______。
(3)溶液C可溶解铜片,若反应过程中C中某离子浓度变化如图中①所示,请写出用铜离子表达的0~t1阶段的化学反应速率:v(Cu2+)=______;相对①,②可能改变的实验条件是______。

(4)已知![]() 的KI溶液中存在平衡I2+I-
的KI溶液中存在平衡I2+I-![]() I3-,该平衡常数K的表达式为:______,在
I3-,该平衡常数K的表达式为:______,在![]() 的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
(5)F是一种二元酸H2M(M代表酸根)的溶液。T℃时,向某浓度的H2M溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2M、HM-、M2-的物质的量分数(![]() )与pH的关系如图所示:
)与pH的关系如图所示:

①若H2M的电离常数分别为K1与K2,则![]() ______。
______。
②按投料比n(Na2M):n(NaHM)=2:1配成溶液,下列有关该溶液的叙述正确的是______(填序号)。
A.该溶液的pH为=7.0
B.3c(Na+)+c(H+)=c(OH-)+c(HM-)+2c(M2-)
C.3c(Na+)=5[c(HM-)+c(M2-)+c(H2M)]
D.3c(OH-)+ c(M2-)=3c(H+)+2c(HM-)+5c(H2M)
(6)若F与I2的KI溶液恰好完全反应,写出反应的化学方程式______;在反应后的溶液加入足量AgNO3溶液充分反应,测得混合体系中c(I-)=amol/L,则c(SO42-)=______mol/L(已知25℃时,Ksp(AgI)=8.3×10-17,Ksp(Ag2SO4)=1.4×10-5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间生成nmol的A2同时生成nmol的AB
B.容器内的压强不随时间变化
C.单位时间生成2nmol的AB同时生成nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是( )
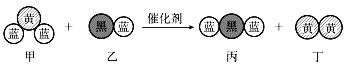
A.反应属于氧化还原反应B.丁物质一定是非金属单质
C.配平后甲、乙、丙的化学计量数均为2D.甲和丙中同种元素的化合价不可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸热反应H2S(g)+CO2(g)![]() COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(H2S):c(CO2):c(COS):c(H2O)=1:1:1:1
D.单位时间内,断开H-S键的数目和生成H-O键的数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向aL密闭容器中加入1molO2和2molNO,发生如下反应:O2(g)+2NO(g)![]() 2NO2(g),下列条件下,此反应不一定达平衡的是( )
2NO2(g),下列条件下,此反应不一定达平衡的是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1∶2∶2
D.单位时间内生成1molO=O,同时生成2molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
(1)火焰利用了部分金属元素特征的__________反应,该反应属于__________(填“物理”或“化学”)变化。
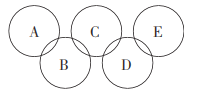
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为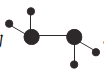 ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,两元素的原子序数之比为2:1。根据以上信息回答下列问题:
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,两元素的原子序数之比为2:1。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为___________________,D的化学式是___________________。
②A、B、E中均含有的一种元素为___________________(填元素名称)。
③E的电子式为___________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1mol B参加反应放出热量Q kJ,其反应的热化学方程式为___________________。
⑤![]() 分子中的N原子有一对孤对电子,能发生反应:
分子中的N原子有一对孤对电子,能发生反应:![]() 。试写出E与足量盐酸发生反应的化学方程式:______________________________________。
。试写出E与足量盐酸发生反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是烃类物质中非常重要的一类烃,应用非常广泛。请回答下列问题:
(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱图表明分子中含有碳碳双键,核磁共振氢谱图表明分子中只有1种类型的氢原子。
①A的结构简式为__;
②A分子中的碳原子是否处于同一平面?__(填“是”或者“不是”)
(2)烯烃与高锰酸钾酸性溶液反应的氧化产物有如下关系:
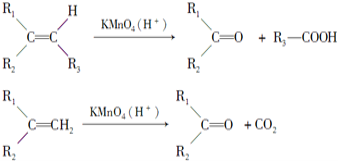
①乙烯是结构最简单的烯烃,写出实验室制取乙烯的反应方程式__,要除去混在甲烷中的乙烯,能否通过酸性高锰酸钾溶液来达到实验目的?__(填“能”或“不能”),理由是__。乙烯是一种基本的化工原料,它的产量可用来衡量一个国家石油化工发展的水平,除此之外乙烯还可用作__。
②已知某烯烃的分子式为C5H10,与高锰酸钾酸性溶液反应的氧化产物之一为CO2,则满足条件的烯烃有___种结构(用数字作答);若与高锰酸钾酸性溶液反应的氧化产物为丙酮和乙酸,则满足条件的烯烃结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是( )
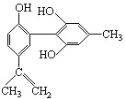
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入酸性KMnO4溶液,溶液紫色褪去,证明结构中存在碳碳双键
C.该物质与足量碳酸钠溶液充分反应一定不会放出CO2
D.1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6mol、7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com