
��NA��ʾ�����ӵ���������ֵ������˵����ȷ����(����)��
A��25 ��ʱ��pH��2��1.0 L H2SO4��Һ�к���H������ĿΪ0.02 NA
B��0.5 mol�ۻ�(As4S4������ԭ�Ӷ�����8���ӽṹ���ṹ��ͼ)����NA��S��S��
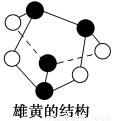
C��39 g�������й���6 NA�����۵���
D����FeI2��NaBr�Ļ����Һ��ͨ����������������1 mol Fe2��������ʱ���÷�Ӧת�Ƶ��ӵ���Ŀ����Ϊ3 NA
 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ���ͳ����ϰ ����ʵ���⣨�����棩 ���ͣ�ѡ����
�����й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ� ��
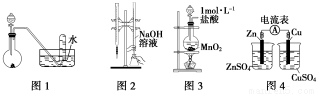
A����ͼ1��ʾװ�ý���ϡ������ͭ�ķ�Ӧ��ȡ���ռ�NO
B����ͼ2��ʾװ�ý�������֪Ũ�ȵ�����������Һ�ⶨ����Ũ�ȵ�ʵ��
C����ͼ3��ʾװ����ȡ����Cl2
D����ͼ4��ʾװ�ü�������ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�ר��3���������ӹ��漰���ӷ���ʽ��д��ϰ���������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ���ʽΪ�� ����
A��̼��������Һ�е�������������Һ��HCO3����OH��=CO32����H2O
B����������ͨ�����������Һ��SO2��ClO����2OH��=SO42����Cl����H2O
C��������ϡ���BaS��2H��=H2S����Ba2��
D����ǿ����Һ�д���������Fe(OH)3��Ӧ����Na2FeO4��3ClO����2Fe(OH)3=2FeO42����3Cl����H2O��4H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��4 ������������ר��ͻ����ϰ���������棩 ���ͣ������
����һ�ֹ��ɽ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ�������Ԫ�ؿ���ǿ�Ͻ��ǿ�ȡ�Ӳ�ȡ��ɺ��Լ����ԣ�������ǿ�����¼���ʴ���ܡ���ͼ�ǻ����������Ʊ����������Ҫ����ͼ��
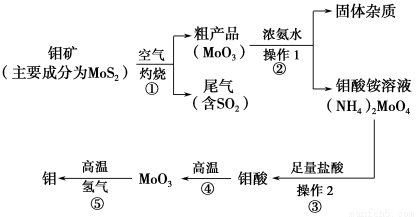
(1)д����Ӧ�ٵĻ�ѧ����ʽ�� ��
(2)��Ӧ�ٵ�β�����������ã�д��Ӧ�ø�β���Ƶõ�������Ҫ��ѧ�Լ� ��
(3)�����ʵ����ģ�����1�Ͳ���2������Ҫʹ�õ���Ҫ���������� ��
(4)���ڿ��������������������⣬����������������������Һ���������ƣ��������ⲻ���������ϡ���ᡣ�����ƵĻ�ѧʽΪ ��
(5)��ҵ���Ʊ���ԭ������CO��H2�ķ�Ӧԭ��ΪCO2��CH4 2CO��2H2��CH4��H2O
2CO��2H2��CH4��H2O CO��3H2���������������Ϊ80%��a L(��״��)��Ȼ��������������̼��ˮ�����Ļ�����ڸ����·�Ӧ������ת����Ϊ90%���ò����Ļ�ԭ������(CO��H2)��ԭMoO3���⣬�������������������Ϊ ��
CO��3H2���������������Ϊ80%��a L(��״��)��Ȼ��������������̼��ˮ�����Ļ�����ڸ����·�Ӧ������ת����Ϊ90%���ò����Ļ�ԭ������(CO��H2)��ԭMoO3���⣬�������������������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��2 �����ӵ��������ж���ϰ���������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�����ֵ������������ȷ����(����)��
A��0.05 mol���ڵ�NaHSO4�к��е���������Ϊ0.10 NA
B��25 �棬pH��12��1 L��ˮ�к��е�OH����Ϊ0.01 NA
C��11.2 L��ϩ����Ȳ�Ļ�������к��е�̼ԭ����ΪNA
D��5.6 g Fe������������ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��2 �����ӵ��������ж���ϰ���������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ���������ֵ�������й�˵������ȷ���ǣ� ����
A��15 g CH3����������Ϊ10 NA
B��78 g Na2O2����������ԭ��Ӧ��ת�Ƶ�����һ����NA
C��һ�������£����ܱ������г���1 mol N2��3 mol H2��������ѧ��Ӧת�Ƶ�����Ϊ6 NA
D��22.4 L(�����)����������������ͭ��һ�������·�����Ӧ��ת�Ƶ�������Ϊ2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��2 �����ӵ��������ж���ϰ���������棩 ���ͣ�ѡ����
��NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ� ����
A�����³�ѹ�£�8 g O2����4NA������
B��1 L 0.1 mol��L��1�İ�ˮ����0.1NA��NH4��
C����״���£�22.4 L���Ậ��NA��HCl����
D��1 mol Na����ȫ��������Na2O2��ʧȥ2NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014����л�ѧ³�ư�ѡ���ĵ�3�� ������ˮ��Һ�е���Ϊ��ϰ���������棩 ���ͣ�ѡ����
������Һ�д��ڵ���ƽ�⣺CH3COOH H����CH3COO��������������ȷ����(����)
H����CH3COO��������������ȷ����(����)
A��������Һ������Ũ�ȵĹ�ϵ���㣺c(H��)��c(OH��)��c(CH3COO��)
B��0.10 mol��L��1��CH3COOH��Һ��ˮϡ�ͣ���Һ��c(OH��)��С
C��CH3COOH��Һ�м���������CH3COONa���壬ƽ�������ƶ�
D�������£�pH��2��CH3COOH��Һ��pH��12��NaOH��Һ�������Ϻ���Һ��pH<7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014����л�ѧ�ս̰�ѡ����ģ���ۺϼ����ϰ���������棩 ���ͣ������
Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ���ʱ䣬����ȡ��Ӧ��ʩ����ѧ��Ӧ���ʱ�ͨ����ʵ����вⶨ��Ҳ�ɽ����������㡣
(1)ʵ���ã�1 g�״��������г��ȼ�����ɶ�����̼��Һ̬ˮ�ͷų�22.7 kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ__________________________________
(2)��֪��ӦCH3��CH3(g)�D��CH2=CH2(g)��H2(g)���йػ�ѧ���ļ������¡�
��ѧ�� | C��H | C=C | C��C | H��H |
����/kJ��mol��1 | 414.4 | 615.3 | 347.4 | 435.3 |
�Լ���÷�Ӧ�ķ�Ӧ��___________________________
(3)���ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�����������㡣�����������Ȼ�ѧ����ʽ�����㷴Ӧ2C(s)��2H2(g)��O2(g)=CH3COOH(l)���ʱ䦤H��________��
��CH3COOH(l)��2O2(g)=2CO2(g)��2H2O(l)����H1����870.3 kJ��mol��1
��C(s)��O2(g)=CO2(g)����H2����393.5 kJ��mol��1
��H2(g)��1/2O2(g)=H2O(l)
��H3����285.8 kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com