
【题目】常温下,![]() 的三种盐溶液
的三种盐溶液![]() 的pH分别为7、8、9,则下列比较中正确的是( )
的pH分别为7、8、9,则下列比较中正确的是( )
A.![]() 的酸性依次增强
的酸性依次增强
B.溶液中的离子浓度![]()
C.电离常数![]() ,水解常数
,水解常数![]()
D.![]()
【答案】D
【解析】
常温下,0.1mol/L的三种盐溶液NaX.NaY.NaZ的pH分别为7、8、9,对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HY>XZ,由此分析解答.
A、对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HX>HY>XZ,故A错误;
B、酸越弱水解的程度越大,离子浓度越小,所以c(X-)>c(Y-)>c(Z-),故B错误;
C、对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HX>HY>XZ,电离常数K(HY)>K(HZ),酸性越弱,对应的盐水解程度越大,水解常数K(Y-)<K(Z-),故C错误;
D、NaX电离后不水解,X-的物质的量浓度c(X-)=0.1mol/L,NaY、NaZ电离后都部分水解,根据物料守恒可知:c(Y-)+c(HY)=0.1mol/L;c(Z-)+c(HZ)=0.1mol/L,所以c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ),故D正确;
故答案为:D。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)![]() 2Z(g);△H<0。若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0。若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为___。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲。
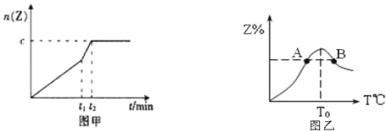
若c=0.90mol,t1时刻改变的条件是___(填选项编号,A.升温B.降温C.加压D.减压E.加催化剂),t2___5min(填“>”,“<”或“=”下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量___0.9mol(填“>”,“<”或“=”)。
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
①A、B两点Z物质正反应速率的大小关系是___;
②温度T<T0时,Z%逐渐增大的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
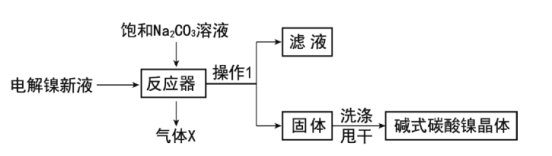
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。

(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:

资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:

(7)写出制备Ni的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛,再加热脱水可生成烯醛类化合物:CH3CHO+CH3CHO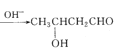
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

请回答:
(1)肉桂醛F的结构简式为____。E中含氧官能团的名称为____。
(2)写出下列转化的化学方程式
②_____。
③_____。
(3)符合下列要求的E物质的同分异构体有____种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
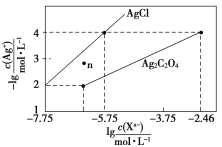
A.Ksp(Ag2C2O4)的数量级等于10-11
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)![]() 可溶解在
可溶解在![]() 溶液中的原因是____________________________________________________。
溶液中的原因是____________________________________________________。
(2)直接蒸发![]() 溶液,能不能得到
溶液,能不能得到![]() 晶体,其正确的操作__________________________。
晶体,其正确的操作__________________________。
(3)在![]() 溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的
溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的![]() 溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
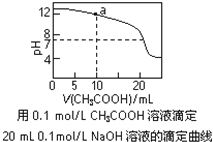
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: ![]() (g)
(g)![]()
 (g)+H2(g) △H=+17.6kJ/mol。
(g)+H2(g) △H=+17.6kJ/mol。
(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有___________。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的![]() ______。
______。
(3)CO2气氛下乙苯催化脱氢可同时存在图1两种途径:

①b=_______kJ/mol。
②途径I的反应历程图所示,下列说法正确的是______________。
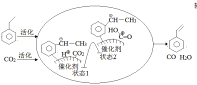
a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有(![]() )
)
d.该催化剂可提高乙苯的平衡转化率
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com