
【题目】将64gCu与一定浓度的HNO3反应,Cu全部反应完后,收集到标准状况下NO和NO2混合气体22.4L。请回答下列问题:
(1)Cu与HNO3反应生成NO的离子方程式为____________________。该反应体现的HNO3的性质为______(填字母)。
A.强氧化性 B.酸性 C.不稳定性 D.易挥发性
(2)参加反应的Cu转移电子的数目为______。
(3)该反应中消耗HNO3的物质的量为______。
【答案】3Cu+8H+ +2NO3-=3Cu2+ + 2NO↑ +4H2O A,B 2NA 3mol
【解析】
(1)Cu与HNO3反应生成NO的化学方程式为3Cu+8HNO3=3Cu(NO3)2 +2NO↑ +4H2O,离子反应方程式为:3Cu+8H+ +2NO3-=3Cu2+ + 2NO↑ +4H2O;反应物HNO3中氮的化合价由+5变为+2价,体现强氧化性,同时生成了硝酸盐,体现了酸性,故选A、B;
(2)64gCu全部反应转化为Cu2+,64gCu的物质的量=![]() =1mol,而1mol铜转移2mol电子,即2NA个电子,故答案为:2NA;
=1mol,而1mol铜转移2mol电子,即2NA个电子,故答案为:2NA;
(3)根据反应原理和质量守恒,消耗HNO3中的N全部存在于Cu(NO3)2、NO和NO2中,而NO和NO2混合气体22.4L,在标准状况下为1mol,这部分消耗了1mol HNO3;1mol铜全部反应可生成1mol Cu(NO3)2,这部分消耗了2mol HNO3,故答案为3mol。


科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是
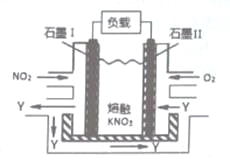
A.NO2在石墨I附近发生氧化反应
B.该电池放电时N03-向石墨I电极迁移
C.石墨Ⅱ附近发生的反应:O2+4e-+2N205=4N03-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为l:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体相对于氢气的密度为9.5,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为( )
A.![]() mLB.
mLB.![]() mLC.
mLC.![]() mLD.无法判断
mLD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①中溶液上层无色,下层紫红色B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水D.装置④中液体蒸干后停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe(OH)SO4]n能用做净水剂(絮凝剂),可由绿矾(FeSO47H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗![]() molKClO3
molKClO3
B.生成聚合硫酸铁后,水溶液的pH增大
C.聚合硫酸铁可在水溶液中水解生成氢氧化铁胶体而净水
D.在反应中氧化剂和还原剂物质的量之比为1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素甲 ~ 辛在周期表中的位置如表所示,下列说法错误的是( )

A.元素甲、丁、戊的单质都是金属
B.元素乙、丙、辛都是非金属元素
C.元素乙、庚、辛都能形成氧化物
D.己的氧化物既可溶于![]() 溶液又可溶于稀硫酸
溶液又可溶于稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
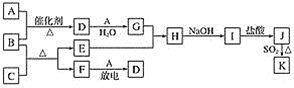
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com