
| A�� | ��ͬѧ�ķ������� | |
| B�� | ��ͬѧ�ķ������� | |
| C�� | �ס�����λͬѧ�ķ������о����� | |
| D�� | �ס�����λͬѧ��ʵ�����漰��±����������һ�� |
���� ±��������������ˮ��Һ���������·���ˮ�ⷴӦ�����������ƴ���Һ���������·�����ȥ��Ӧ�������Ƿ�����Ԫ�أ��ڷ���ˮ�⡢��ȥ��Ӧ�����Һ��Ӧ�ȼ��������ữ����ֹ����AgOH������Ӱ��ʵ�������Դ˽����⣮
��� �⣺��±��������ȥ��Ӧ�����������㣺һ��������2��Cԭ�ӣ�����������±��ԭ�ӵ�Cԭ�����ڵ�Cԭ���ϱ�����Hԭ�ӣ��ڼ���±����������±�ص���ȷ������ȡ±������NaOH��Һ���ȣ���ȴ�����ϡ�����ữ���ټ�����������Һ���۲������ɫ��
���ַ���������������ͬѧ���ڼ��������ȴ��û�м���ϡ�����ữ����ͬѧ����������±��������ȥ��Ӧ����±�����е�±ԭ��ת��Ϊ±�����ӣ��ټ����������м��飬��±��������ȥ��Ӧ����ǰ��ģ���CH3Br�ȾͲ��ܷ�����ȥ��Ӧ�����Դ˷��о����ԣ�
��ѡC��
���� ���⿼�����ʵļ���ͼ����ʵ�鷽������ƺ����ۣ�Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬ע��������ʵ������Լ�ʵ��������ԡ������Ե����ۣ��ѶȲ���


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¶��ܼӿ췴Ӧ���� | B�� | ʹ��ǡ���Ĵ����ܼӿ췴Ӧ���� | ||
| C�� | ����O2��Ũ���ܼӿ췴Ӧ���� | D�� | SO2��O2��100%ת��ΪSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | 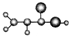 ����C��H��O����Ԫ����� �����ģ��Ϊ�� ������NH3��һ�������·�Ӧ���ɱ�ϩ����CH2=CHCONH2 ����Է�������Ϊ72 |
| B | ����C��H��O����Ԫ����ɡ�������Na��Ӧ����������NaOH��Һ��Ӧ ������A��Ӧ������Է�������Ϊ100���� |
| C | ����Է���������B��ͬ�����ܱ����Ƶ�������ͭ����Һ���� ������NaHCO3��Һ��Ӧ�ų�CO2���� |
| D | ����ʹ������Ȼ�̼��Һ��ɫ��������ˮ��һ�������·�Ӧ����B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | V���棩��V������ | B�� | V���棩��V������ | ||
| C�� | V���棩��V�����������淴Ӧֹͣ | D�� | V���棩=V�����������淴Ӧ�Խ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
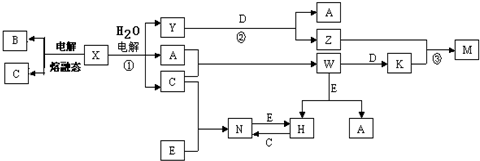
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��ʱpH=10��NaOH��Һ��pH=10�İ�ˮ�У�c��Na+����c��NH${\;}_{4}^{+}$�� | |
| B�� | ���ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ�c��CH3COO-��+c��OH-��=c��H+��+c��CH3COOH�� | |
| C�� | ��NaHA��Һ�У�H2AΪ���ᣩ��c��Na+����c��HA-����c��OH-����c��H+�� | |
| D�� | �����£���0.01 mol•L-1 NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ�c��Na+����c��SO${\;}_{4}^{2-}$����c��NH${\;}_{4}^{+}$����c��OH-��=c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2mol Na+ | B�� | 0.05mol CO${\;}_{3}^{2-}$ | ||
| C�� | 6.02��1023��O | D�� | 0.1mol H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
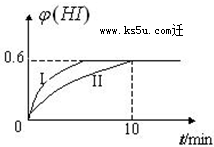 ��1mol I2��g�� ��2mol H2��g������2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g������H��0��2minʱ�����I2�����ʵ���Ϊ0.6mol��10min��ﵽƽ�⣬HI����������գ�H����ʱ��仯����ͼ������II��ʾ��
��1mol I2��g�� ��2mol H2��g������2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g������H��0��2minʱ�����I2�����ʵ���Ϊ0.6mol��10min��ﵽƽ�⣬HI����������գ�H����ʱ��仯����ͼ������II��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com