
【题目】现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1:①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2:①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧至质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________________________。
(2)实验室配制FeCl2溶液时通常会向其中加入少量试剂________________。
(3)“实验2”通入足量Cl2的目的是_________。涉及的化学反应的离子方程式是__________。
(4)检验“实验2”的步骤④中沉淀已经洗涤干净的方法是________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(化学方程式与文字相结合来说明)____________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的相关性质。以下关于胶体的说法正确的是________
A.胶体的分散质能透过滤纸
B.实验室制备胶体Fe(OH)3胶体,是将饱和FeCl3溶液滴入热的NaOH溶液中,加热至溶液变为红褐色
C.当光束通过胶体时能产生丁达尔效应
D.胶体、溶液、浊液中,含分散质粒子直径最大的分散系是胶体
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比是________。
【答案】烧杯、玻璃棒 稀盐酸、铁粉 将Fe2+全部转化为Fe3+ 2Fe2++Cl2=2Fe3++2Cl- 向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净 FeCl3在水中存在如下平衡FeCl3+3H2O![]() Fe(OH)3+3HCl 。在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体 AC 2∶3
Fe(OH)3+3HCl 。在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体 AC 2∶3
【解析】
(1)溶解所用到的仪器为:烧杯、玻璃棒;
(2)为了防止FeCl2溶液水解、氧化应加入稀盐酸、铁粉;
(3)“实验2”通入足量Cl2的目的是将FeCl2氧化生成FeCl3;
(4)首先要明确沉淀中所含杂质,此题中的杂质是Na+、Cl-,检验沉淀是否洗涤干净,只要检验洗涤后的溶液中是否含有Na+、Cl-中的一种就可以;
(5)因为FeCl3易水解,且HCl易挥发,加热促进了FeCl3水解及HCl的挥发,所以不能得到FeCl3固体;
(6)根据分散质粒子直径的大小把分散系分为:胶体、溶液、浊液;丁达尔效应是胶体特有的性质;
(7)有关混合物的计算,利用元素守恒来解答。
(1)溶解所用到的仪器为:烧杯、玻璃棒;故答案为:烧杯、玻璃棒;
(2)防止溶液里的Fe2+被氧化要加入铁粉,防止亚铁离子水解需要加入对应酸,实验室保存FeCl2溶液时通常会向其中加入少量试剂铁粉、稀盐酸,故答案为:铁粉、稀盐酸;
(3)Cl2将FeCl2氧化生成FeCl3:Cl2+2FeCl2=2FeCl3,故答案为:将Fe2+全部转化为Fe3+;2Fe2++Cl2=2Fe3++2Cl-;
(4)检验沉淀已经洗涤干净的方法是:向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净;故答案为:向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净;
(5)因为FeCl3易水解,且HCl易挥发,加热促进了FeCl3水解及HCl的挥发,所以不能得到FeCl3固体;故答案为:FeCl3在水中存在如下平衡FeCl3+3H2O![]() Fe(OH)3+3HCl 。在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体;
Fe(OH)3+3HCl 。在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体;
(6)A. 胶体的分散质能透过滤纸,故A正确;
B. 实验室制备Fe(OH)3胶体,是向沸水中逐滴加入饱和FeCl3溶液,继续煮沸,至溶液变为红褐色;故B错误;
C.丁达尔效应是胶体特有的性质,故C正确;
D. 胶体、溶液、浊液中,含分散质粒子直径最大的分散系是浊液,故D错误;
故选AC。
(7)设FeCl3为x mol,FeCl2为y mol,
![]()
![]() ,依据Cl、Fe守恒3x mol+2y mol=0.12 mol,x mol+y mol=0.025 mol×2,解得x=0.02,y=0.03;
,依据Cl、Fe守恒3x mol+2y mol=0.12 mol,x mol+y mol=0.025 mol×2,解得x=0.02,y=0.03;
固体样品中FeCl3和FeCl2的物质的量之比为2:3;
故答案为:2:3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】FeBr2可用作有机合成的催化剂,某校同学设计实验用干燥的HBr与Fe反应制备少量FeBr2,实验装置如下(部分夹持装置已省略):

已知:高温时FeBr3会分解为FeBr2,FeBr2易吸水潮解,800℃以上可升华。
回答下列问题:
(1)仪器M的名称是____________;装置①中生成HBr的化学方程式为___________。
(2)反应开始前通入N2的目的是____________,反应过程中通入N2的目的是____________。
(3)进入装置④的气体中混有少量Br2对产品纯度_______(填“有”或“没有”)影响,理由是___________。
(4)装置⑥的作用是___________,逸出的气体主要是___________(填化学式)。
(5)设计实验方案探究得到的FeBr2中Fe2+和Brˉ的还原性强弱:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
C. 每消耗1molX同时生成2mol Z,说明反应已达平衡
D. 反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
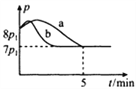
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳和硅的叙述不正确的是( )
A. 最高价氧化物都能与氢氧化钠溶液反应 B. 单质在加热时都能与O2反应
C. 氧化物都能与水反应生成相应的酸 D. 在常温下,单质的化学性质都不活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
A. 乙烷和乙烯 B. 乙烷和乙烯 C. 甲烷和乙烯 D. 甲烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在 2 L 的密闭容器中,气体 X、Y 和 Z 三种物质的物质的量随时间变化的曲线如图所示,下列描述正确的是

A. 容器中化学反应为 X(g)+Y(g)![]() Z(g)
Z(g)
B. 0~10 s,X 表示的平均化学反应速率为 0.04 mol/(L·s)
C. 使用催化剂只能加快 0~10 s 间的反应速率
D. 0~4 s 的平均反应速率小于 0~10 s 的平均反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com