
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| B. | 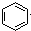 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$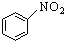 | |
| C. | CH3CH=CH2+B2r→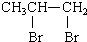 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH+H2O |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
常见能发生加成反应的物质往往含有C=C、C≡C、C=O等官能团,以此解答该题.
解答 解:A.有单质参加和生成,为置换反应,故A错误;
B.硝基取代苯环的H,为取代反应,故B错误;
C.丙烯含有碳碳双键,与溴水反应生成C-C键,为加成反应,故C正确;
D.为酯化反应,也为取代反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,侧重于有机物反应类型的判断,注意把握有机物的官能团的性质以及转化,注意相关基础知识的积累.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 在周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共18个纵行 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空:
国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:1:6 | B. | 3:1:2 | C. | 3:2:2 | D. | 9:2:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com