
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)铜原子在基态时的价电子排布式为__________。金属铜的结构形式为面心立方最密堆积,晶胞中每个铜原子周围最近的铜原子有________个。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度 加以解释_______________________。
(3)GaC13和AsF3的空间构型分别是:_________,_______。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________;
②[B(OH)4]-的结构式为_________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
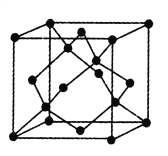
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______________(用化学式表示);
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm (1pm=10-12m)。立方氮化硼的密度是______g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
【答案】(1)3d10(2分)(2)砷的4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大。(2分)
(3)原子晶体109°28′(2分)
(4)平面三角形,三角锥(2分)
(5)①sp3(1分)②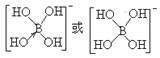 (2分)
(2分)
(6)①C>SiC>Si(2分)②![]() (2分)
(2分)
【解析】试题分析:(1)铜的核电荷数为29,根据构造原理排列为[Ar]3d104s1,Cu+为失去1个电子后达到全满的结构,故价电子排布为3d10;
(2)砷的4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大,所以砷的第一电离能大于硒。
(3)GaAs熔点1238℃,难溶于溶剂,说明晶体类型为原子晶体,根据Ga、As原子结构推测,GaAs晶体与金刚石类似,其键角为109°28′。
(4)GaCl3和AsF3的中心原子价层电子对数分别是3、3+(5-1×3)/2=4,所以空间构型分别是平面三角形,三角锥。
(5)①[B(OH)4]-中B原子的价层电子对数是4,杂化类型为sp3。
②硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性,这说明[B(OH)4]-中含有配位键,则结构式为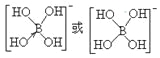 ;
;
(6)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小。熔点越高,即熔点高低顺序为C>SiC>Si。
②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。因此如果晶胞边长为361.5pm,则立方氮化硼的密度是![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】按下列实验方法能够达到要求的是( )
A.用10mL量筒量取7.50mL稀盐酸
B.用湿润的pH试纸测定NaCl溶液的酸碱性
C.用广泛pH试纸测得某碱溶液pH 12.7
D.用托盘天平称量出25.20g NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算:
①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是
A.pH=12的溶液:K+、Na+、CH3COO-、Br-
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、SO42-、C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种的重要方法,下列分类合理的是( )
A. KOH和Na2CO3都属于碱 B. H2SO4和HNO3都属于酸
C. K2CO3和K2O都属于盐 D. Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方一些化工城市雨水pH=4,此时钢铁制品腐蚀的正极反应主要是
A.Fe -2e-=Fe2+B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑D.4OH—-4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,22.4 L庚烷的分子数约为NA
B. 1 L 0.1 mol·L-l的Na2S溶液中S2-和HS-的总数为0.1NA
C. 4.0 g H![]() O与D2O的混合物中所含中子数为2NA
O与D2O的混合物中所含中子数为2NA
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.纯水的pH不一定等于7
B.原电池的两极中较活泼的金属一定为负极
C.硫酸溶液的导电能力一定比醋酸溶液的导电能力强
D.若升高一个可逆反应的温度,该反应化学平衡常数一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.SO2具有还原性,可用于漂白纸浆
B.硅硬度大,可用于制造半导体芯片
C.液氨汽化时要吸热,可用作制冷剂
D.Na2S具有还原性,可作废水中Hg2+的沉淀剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com