
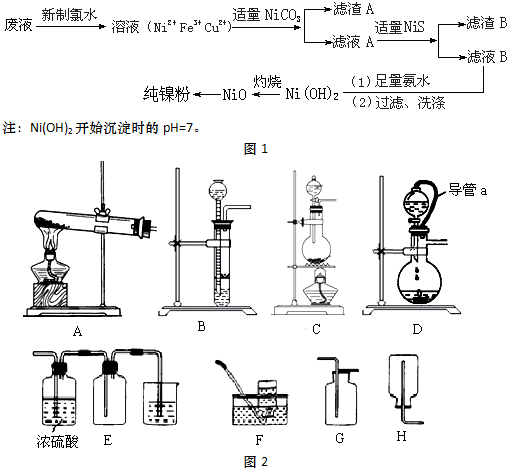
| 难溶电解质 | NiS | CuS | Cu(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp或沉淀完全的pH | 1.1×10-21 | 1.3×10-36 | pH=9 | pH=9.5 | pH=3.7 |
分析 电镀废液(含有NiSO4、CuSO4和FeSO4)加新制氯水,亚铁离子被氧化为Fe3+,加入NiCO3调节pH,使Fe3+转化为Fe(OH)3沉淀,过滤,滤渣A为 Fe(OH)3沉淀,滤液A中含有Ni2+和Cu2+,再加适量的NiS,Cu2+转化为CuS沉淀,过滤,滤渣B为CuS沉淀,滤液B为NiSO4,加足量的氨水,生成Ni(OH)2沉淀,过滤、洗涤得到Ni(OH)2,灼烧得到NiO,最后还原得到Ni;
(1)加新制氯水,亚铁离子被氧化为Fe3+;
(2)调节溶液pH使Fe3+转化为Fe(OH)3沉淀;
(3)根据灼烧的实验操作分析;
(4)通过金属之间的置换反应提取Ni,操作简便、节省原料、安全;用氢气还原不会引入杂质;
(5)制备氢气用稀硫酸与Zn反应,属于固液不需要加热的装置;收集氢气用向下排空气法或排水法;
(6)D装置属于固液不需要加热的装置,E装置用浓硫酸干燥,向上排空气法收集,尾气需要处理;分液漏斗与烧瓶用胶管连接时压强相同.
解答 解:电镀废液(含有NiSO4、CuSO4和FeSO4)加新制氯水,亚铁离子被氧化为Fe3+,加入NiCO3调节pH,使Fe3+转化为Fe(OH)3沉淀,过滤,滤渣A为 Fe(OH)3沉淀,滤液A中含有Ni2+和Cu2+,再加适量的NiS,Cu2+转化为CuS沉淀,过滤,滤渣B为CuS沉淀,滤液B为NiSO4,加足量的氨水,生成Ni(OH)2沉淀,过滤、洗涤得到Ni(OH)2,灼烧得到NiO,最后还原得到Ni;
(1)电镀废液中含有Fe2+,加新制氯水,亚铁离子被氧化为Fe3+,其反应的离子方程式为:Cl2+2Fe2+═2Fe3++2Cl-;
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(2)由流出分析可知Fe3+为杂质,所以加入NiCO3,调节溶液pH使Fe3+转化为Fe(OH)3沉淀而去除,由表格中数据可知pH=3.7时铁离子完全沉淀,
故答案为:调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去;
(3)灼烧时用到坩埚,加热仪器酒精灯,还有三脚架、泥三角和坩埚钳,
故答案为:酒精灯、三脚架、泥三角、坩埚、坩埚钳;
(4)方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥,通过金属之间的置换反应提取Ni,操作简便、节省原料、安全,但是易引入杂质Zn;
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍;用氢气还原不会引入杂质,所以得到的产品纯度较高,但是操作较复杂、会有空气是会发生爆炸;
故答案为:操作简便、节省原料、实验安全;产品纯度较高;
(5)制备氢气用稀硫酸与Zn反应,属于固液不需要加热的装置,所以可以选用BD;氢气的密度比空气小,收集氢气用向下排空气法,氢气难溶于水,可以用排水法收集,则选用FH;
故答案为:BD;FH;
(6)D装置属于固液不需要加热的装置,E装置用浓硫酸干燥,说明该气体与浓硫酸不反应,向上排空气法收集,则该气体的密度大于空气,尾气需要处理,说明该气体有毒会污染空气,所以符合条件的气体为SO2;分液漏斗与烧瓶用胶管连接时压强相同,便于分液漏斗中液体顺利流下;
故答案为:d;平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
点评 本题考查了物质分离的实验设计和物质制备方案设计,涉及氧化还原反应、利用溶液不同PH条件下离子沉淀的情况不同控制溶液PH除去杂质离子、气体的制备方法和仪器选择等,题目难度中等,注意除杂原则不能引入新的杂质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
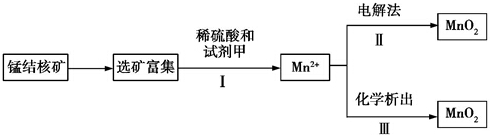
| A. | 步骤Ⅰ中的试剂甲必须具有较强的还原性 | |
| B. | 步骤Ⅲ发生反应的离子方程式为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+ | |
| C. | 若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O═MnO2+4H+ | |
| D. | 测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol•L-1HCl标准溶液滴定的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷与氯气在光照条件下生成氯丙烷 | |
| B. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| C. | 乙烯与水反应生成乙醇 | |
| D. | 乙烯自身聚合生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)=0.1mol•L-1•s-1 | B. | v(H2)=0.1mol•L-1•min-1 | ||
| C. | v(NH3)=0.15mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com