
”¾ĢāÄæ”æijŠ£»Æѧъ¾æŠŌѧĻ°Š”×éÓūÉč¼ĘŹµŃéŃéÖ¤Fe”¢CuµÄ½šŹō»ī¶ÆŠŌ£¬ĖūĆĒĢį³öĮĖŅŌĻĀĮ½ÖÖ·½°ø”£ĒėÄć°ļÖśĖūĆĒĶź³ÉÓŠ¹ŲŹµŃéĻīÄæ£ŗ
·½°ø¢ń£ŗÓŠČĖĢį³ö½«“óŠ”ĻąµČµÄĢśĘ¬ŗĶĶʬ£¬·Ö±šĶ¬Ź±·ÅČėĻ”ĮņĖį(»ņĻ”ŃĪĖį)ÖŠ£¬¹Ū²ģ²śÉśĘųÅŻµÄæģĀż£¬¾Ż“ĖČ·¶ØĖüĆĒµÄ»ī¶ÆŠŌ”£øĆŌĄķµÄĄė×Ó·½³ĢŹ½ĪŖ___________________”£
·½°ø¢ņ£ŗÓŠČĖĄūÓĆFe”¢Cu×÷µē¼«Éč¼Ę³ÉŌµē³Ų£¬ŅŌČ·¶ØĖüĆĒµÄ»ī¶ÆŠŌ”£ŹŌŌŚĻĀĆęµÄ·½æņÄŚ»³öŌµē³Ų×°ÖĆĶ¼£¬±ź³öŌµē³ŲµÄµē¼«²ÄĮĻŗĶµē½āÖŹČÜŅŗ£¬²¢Š“³öµē¼«·“Ó¦Ź½”£

Õż¼«·“Ó¦Ź½£ŗ____________________”£
øŗ¼«·“Ó¦Ź½£ŗ____________________”£
·½°ø¢ó£ŗ½įŗĻÄćĖłŃ§µÄÖŖŹ¶£¬°ļÖśĖūĆĒŌŁÉč¼ĘŅ»øöŃéÖ¤Fe”¢Cu»ī¶ÆŠŌµÄ¼ņµ„ŹµŃé·½°ø(Óė·½°ø¢ń”¢¢ņ²»ÄÜĄ×Ķ¬)£ŗ________________£¬ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾Ęä·“Ó¦ŌĄķ£ŗ_____________________”£
”¾“š°ø”æ·½°ø¢ń£ŗFe£«2H£«===Fe2£«£«H2”ü£»
·½°ø¢ņ£ŗ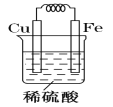 £»2H++2e-=H2”ü£¬Fe-2e-=Fe2+£»·½°ø¢ó:½«ĢśĘ¬ÖĆÓŚCuSO4ČÜŅŗ£¬ČōĢś°ō±ķĆęø²øĒŅ»²ćĶ£¬ĖµĆ÷Fe±ČCu»ī¶ÆŠŌĒ棬Fe£«Cu2£«===Fe2£«£«Cu(ŗĻĄķ¼“æÉ)”£
£»2H++2e-=H2”ü£¬Fe-2e-=Fe2+£»·½°ø¢ó:½«ĢśĘ¬ÖĆÓŚCuSO4ČÜŅŗ£¬ČōĢś°ō±ķĆęø²øĒŅ»²ćĶ£¬ĖµĆ÷Fe±ČCu»ī¶ÆŠŌĒ棬Fe£«Cu2£«===Fe2£«£«Cu(ŗĻĄķ¼“æÉ)”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ·½°øI£ŗøł¾Ż½šŹō»ī¶ÆĖ³Šņ±ķ£¬Ö»ÓŠĢśŗĶŃĪĖį»ņĻ”ĮņĖį·“Ó¦£¬¼“Fe£«2H£«=Fe2£«£«H2”ü£»·½°øII£ŗøł¾ŻŹĒ£Ø1£©µÄ·“Ó¦£¬Ōµē³Ų×°ÖĆĪŖ£ŗ £»Õż¼«·“Ó¦Ź½ĪŖ2H£«£«2e£=H2”ü£¬øŗ¼«·“Ó¦Ź½ĪŖFe£2e£=Fe2£«£»·½°øIII£ŗøł¾Ż½šŹō»ī¶ÆĖ³Šņ±ķ£¬ĢśÄÜ°ŃĶÖĆ»»³öĄ“£¬Ņņ“Ė£ŗ½«ĢśĘ¬ÖĆÓŚCuSO4ČÜŅŗ£¬ČōĢś°ō±ķĆęø²øĒŅ»²ćĶ£¬ĖµĆ÷Fe±ČCu»ī¶ÆŠŌĒ棬Fe£«Cu2£«===Fe2£«£«Cu(ŗĻĄķ¼“æÉ)”£
£»Õż¼«·“Ó¦Ź½ĪŖ2H£«£«2e£=H2”ü£¬øŗ¼«·“Ó¦Ź½ĪŖFe£2e£=Fe2£«£»·½°øIII£ŗøł¾Ż½šŹō»ī¶ÆĖ³Šņ±ķ£¬ĢśÄÜ°ŃĶÖĆ»»³öĄ“£¬Ņņ“Ė£ŗ½«ĢśĘ¬ÖĆÓŚCuSO4ČÜŅŗ£¬ČōĢś°ō±ķĆęø²øĒŅ»²ćĶ£¬ĖµĆ÷Fe±ČCu»ī¶ÆŠŌĒ棬Fe£«Cu2£«===Fe2£«£«Cu(ŗĻĄķ¼“æÉ)”£


 ÓżӾ«¾ķĻµĮŠ“š°ø
ÓżӾ«¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ĘæČÜŅŗÖŠæÉÄÜŗ¬ÓŠMg2+”¢Na+”¢OH£”¢Cl£”¢CO32£ŗĶSO42£ÖŠÄ³¼øÖÖ£¬ĻÖ·Ö±šČ”øĆČÜŅŗÉŁĮæ×°ÓŚĮ½Ö§ŹŌ¹Ü£¬½ųŠŠŅŌĻĀŹµŃé£ŗ
¢ŁĻņµŚŅ»Ö§ŹŌ¹ÜÖŠCČė·ÓĢŖČÜŅŗ£¬ČÜŅŗ±äŗģ£»
¢ŚĻņµŚ¶žÖ§ŹŌ¹ÜÖŠ¼ÓČė×ćĮæBaCl2ČÜŅŗ£¬Éś³É°×É«³Įµķ£¬¹żĀĖ£¬²¢½«ĀĖŅŗŅĘČėµŚČżÖ§ŹŌ¹Ü£¬ŌŚ³ĮµķÖŠ¼ÓČėĻ”ĻõĖį£¬³ĮµķÖš½„ĻūŹ§²¢ÓŠĪŽÉ«ĪŽĪ¶ĘųĢå²śÉś£¬øĆĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ®£¬ŹÆ»ŅĖ®±ä»ė×Ē”£
¢ŪĻņµŚČżÖ§ŹŌ¹ÜÖŠĻČ¼ÓČėĻõĖįĖį»Æ£¬ŌŁ¼ÓČėĻõĖįŅųČÜŅŗ£¬³öĻÖ°×É«³Įµķ£¬ĶعżŅŌÉĻŹµŃéæÉÅŠ¶ĻČÜŅŗÖŠŗ¬ÓŠĄė×ÓĪŖ £¬²»ŗ¬ÓŠµÄĄė×ÓĪŖ £¬ĪŽ·ØČ·¶ØŹĒ·ńŗ¬ÓŠµÄĄė×ÓĪŖ £¬Š“³öŹµŃé¢Ś¢ŪÖŠĖłÓŠÓŠ¹Ų·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÓĆÓŅĶ¼×°ÖĆĶź³ÉĻĀ±ķĖłĮŠµÄĖÄøöŹµŃ飬²»ÄÜ“ļµ½ŹµŃéÄæµÄŹĒ
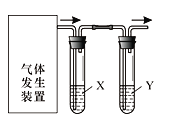
Ń”Ļī | ŹµŃéÄæµÄ | ŹŌ¼ĮX | ŹŌ¼ĮY |
A | ŃéÖ¤C2H5OHÓėÅØH2SO4¼ÓČČÖĮ170”ęÖʵƵÄŅŅĻ©µÄŠŌÖŹ | NaOHČÜŅŗ | Br2Ė® |
B | ¼ģŃéFeSO4ŹÜČČ·Ö½ā²śÉśµÄĘųĢåÖŠÓŠSO3ŗĶSO2 | BaCl2ČÜŅŗ | Ę·ŗģČÜŅŗ |
C | ŃéÖ¤µēŹÆÓė±„ŗĶŹ³ŃĪĖ®·“Ӧɜ³ÉµÄŅŅČ²µÄŠŌÖŹ | CuSO4ČÜŅŗ | KMnO4ČÜŅŗ |
D | ŃéÖ¤Ńõ»ÆŠŌ£ŗCl2£¾Br2£¾I2 | NaBrČÜŅŗ | KIČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»Æѧ·“Ó¦ŹōÓŚĪüČČ·“Ó¦µÄŹĒ
A. ÅØH2SO4ČÜÓŚĖ® B. ÉśŹÆ»ŅČÜÓŚĖ®
C. Ć¾ÓėĻ”ŃĪĖį·“Ó¦ D. NH4Cl¹ĢĢåÓėBa(OH)2”¤8H2O»ģŗĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”¶ł»¼ŲžŁĶ²”£¬·¢ÉÕŹ±¾Ķ»į³é“¤£¬øł¾ŻĖłŃ§ÖŖŹ¶£¬½ØŅéĖūĘ½Ź±ŅŖ²¹³ä
A. ŠĀĻŹĖ®¹ūŗĶŹß²Ė B. øĘʬŗĶĪ¬ÉśĖŲD
C. ¹ČĪļÖÖʤŗĶŗśĀܲ· D. µ°°×ÖŹŗĶĢĒĄą
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij200 mLĀČ»ÆĆ¾ŗĶĀČ»ÆĀĮ»ģŗĻŅŗÖŠc(Mg2£«)ĪŖ0.3 mol/L£¬c(Cl£)ĪŖ1.2 mol/L”£ŅŖŹ¹Mg2£«Č«²æ×Ŗ»ÆĪŖ³Įµķ·ÖĄė³öĄ“£¬ÖĮÉŁŠč¼Ó4 mol/L NaOHČÜŅŗµÄĢå»żĪŖ
A£®70 mL B£®60mL C£®80 mL D£®128 mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉéµÄ³£¼ūĖįŠŌŃõ»ÆĪļÓŠAs2O3ŗĶAs2O5£¬øł¾ŻĶ¼ÖŠŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£ŗ
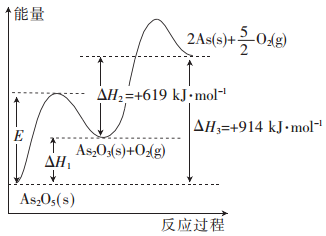
(1)As2O5·Ö½āÉś³ÉAs2O3ŗĶO2µÄ·“Ó¦ÖŠ£¬¼ÓČė“߻ƼĮ£¬E__________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ ”°²»±ä”±£¬ĻĀĶ¬£©£¬”÷H1_________”£
(2)As2O3·Ö½āÉś³ÉAsŗĶO2µÄČČ»Æѧ·½³ĢŹ½ĪŖ____________________”£
(3)As2O3ŗĶO2·“Ӧɜ³ÉAs2O5µÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________________”£
(4)Čō1 mol As2O5·Ö½āÉś³É0.4 mol As2O3ŗĶ1.2 mol As£¬ŌņøĆ·Ö½ā¹ż³ĢÖŠ£¬ŠčĪüŹÕµÄ×ÜÄÜĮæĪŖ_________kJ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)½«Ņ»¶ØĮæµÄĢś·Ū¼ÓČėµ½×°ÓŠ200 mLijÅØ¶ČµÄĻ”ĻõĖįČÜŅŗµÄČŻĘ÷ÖŠ³ä·Ö·“Ó¦”£
¢ŁČŻĘ÷ÖŠŹ£Óąm1 gĢś·Ū£¬ŹÕ¼Æµ½NO±ź×¼×“æöĻĀĢå»żĪŖ672 mL”£
ĖłµĆČÜŅŗÖŠČÜÖŹµÄ»ÆѧŹ½ £¬ŌĻõĖįČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č mol/L”£
¢ŚĻņÉĻŹö¹Ģ”¢Ņŗ»ģŗĻĪļÖŠÖšµĪ¼ÓČėĻ”ĮņĖį£¬Ö±µ½²»ŌŁ²śÉśNOĘųĢåĪŖÖ¹£¬“ĖŹ±ČŻĘ÷ÖŠ»¹Ź£ÓąĢś·Ūm2 g
Ōņ“ĖŹ±ČÜŅŗÖŠČÜÖŹµÄ»ÆѧŹ½ £¬m1-m2 µÄÖµĪŖ g£Ø¾«Č·µ½0.1g )
(2)ĀĮµē³ŲŠŌÄÜÓÅŌ½£¬Al£æÕĘųČ¼ĮĻµē³ŲĶس£ŅŌNaClČÜŅŗ»ņKOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬ĶØČėæÕĘųµÄµē¼«ĪŖÕż¼«£¬ŅŌ¶ąæ׏ÆÄ«ĪŖÕż¼«²ÄĮĻ”£ČōŅŌNaClČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬Õż¼«µÄ·“Ó¦Ź½ĪŖ______________£»ČōŅŌKOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬µē³Ų×Ü·“Ó¦ĪŖ_______________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ0.5Ģå»żÄ³ĘųĢ¬ĢžÖ»ÄÜÓė0.5Ģå»żĀČĘų·¢Éś¼Ó³É·“Ó¦,Éś³ÉĀČ“śĶ飬0.5 mol“ĖĀČ“śĶéæÉÓė3 molĀČĘų·¢ÉśĶźČ«µÄČ”“ś·“Ó¦£¬ŌņøĆĢžµÄ½į¹¹¼ņŹ½ĪŖ( )
A£®CH2£½CH2 B£®CH3CH£½CH2 C£®CH3CH3 D£®CH3CH2CH£½CH2
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com